よむ、つかう、まなぶ。
資料7-6 企業から提出された開発工程表の概要等(第Ⅳ回要望) [336KB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
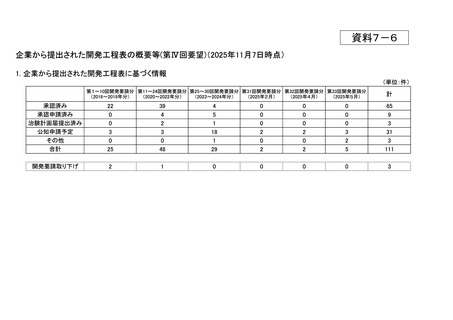
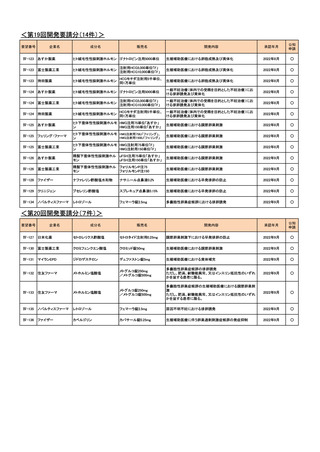
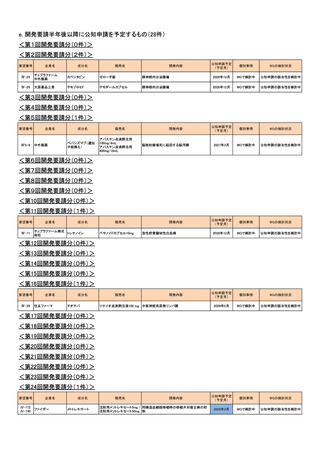
<第13回開発要請分(9件)>
要望番号
企業名
成分名
販売名
開発内容
承認年月
公知
申請
Ⅳ-73
丸石製薬
オンダンセトロン塩酸塩
オンダンセトロン注4mgシリン
術後の消化器症状(悪心、嘔吐)(小児)
ジ「マルイシ」
2022年2月
○
Ⅳ-89
丸石製薬
オンダンセトロン塩酸塩
オンダンセトロン注4mgシリン
術後の消化器症状(悪心、嘔吐)(成人)
ジ「マルイシ」
2022年2月
○
Ⅳ-63
ヤクルト本社
オキサリプラチン
エルプラット点滴静注液
50mg・同100mg・同200mg
治癒切除不能な進行・再発の胃癌
2023年3月
○
【効能・効果】治癒切除不能な進行・再発の胃癌
【用法・用量】レボホリナート・フルオロウラシル持続静注併
用療法
レボホリナートとして1回200 mg/m2(体表面積)を2時間かけ
て点滴静注する。レボホリナートの点滴静注終了直後にフ
ルオロウラシルとして400 mg/m2(体表面積)を静注、さらに
フルオロウラシルとして2400~3000 mg/m2(体表面積)を46
時間持続静注する。これを2週間ごとに繰り返す。
2023年3月
○
2023年3月
○
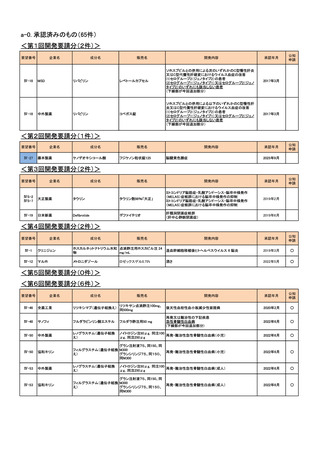
Ⅳ-64
協和キリン
フルオロウラシル
5-FU注250mg、5-FU注
1000mg
Ⅳ-65
ファイザー
レボホリナートカルシウム水
和物
アイソボリン点滴静注用
25mg、アイソボリン点滴静注 治癒切除不能な進行・再発の胃癌
用100mg
Ⅳ-77
ファイザー
ソル・メドロール静注用40mg、
メチルプレドニゾロンコハク酸
川崎病の急性期(重症であり,冠動脈障害の発生の危険が
同125mg、同500mg、同
エステルナトリウム
ある場合)
1000mg
2023年9月
○
Ⅳ-85
協和キリン
ロミプロスチム(遺伝子組換
え)
ロミプレート皮下注250μg調
製用
【効能・効果】慢性特発性血小板減少性紫斑病(小児に関す
る要望)
【用法・用量】ロミプロスチム(遺伝子組換え)として、初回投
与量1 μg/kgを皮下投与する。投与開始後は血小板数、症
状に応じて投与量を適宜増減し、週1回皮下投与する。ま
た、最高投与量は週1回10 μg/kgとする。
2024年11月
○
Ⅳ-84
ノバルティスファーマ
エルトロンボパグ オラミン
レボレード錠12.5 mg、
レボレード錠25 mg
慢性特発性血小板減少性紫斑病(小児)
2024年11月
○
Ⅳ-87
全薬工業
リツキシマブ(遺伝子組換え)
リツキサン点滴静注100mg
リツキサン点滴静注500mg
小児の慢性特発性血小板減少性紫斑病
2024年11月
○
承認年月
公知
申請
2023年9月
○
承認年月
公知
申請
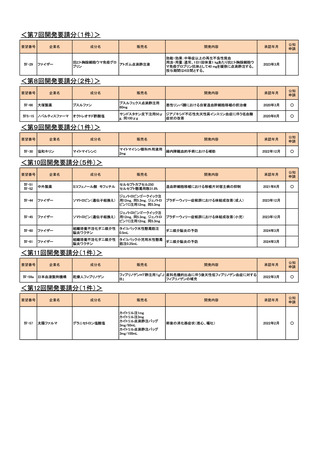
<第14回開発要請分(1件)>
要望番号
Ⅳ-82
企業名
第一三共
成分名
インドシアニングリーン
販売名
開発内容
ジアグノグリーン注射用25mg 肝外胆管(肝門部領域胆管と遠位胆管)の描出
<第15回開発要請分(2件)>
要望番号
Ⅳ-43
Ⅳ-55
企業名
あゆみ製薬
あゆみ製薬
成分名
販売名
開発内容
アセトアミノフェン
カロナール原末
カロナール細粒20%・同50%
カロナール錠200・同300・同
500
下記の疾患並びに症状の鎮痛
関節リウマチ
2023年2月
○
アセトアミノフェン
カロナール原末
カロナール細粒20%・同50%
カロナール錠200・同300・同
500
下記の疾患並びに症状の鎮痛
術後疼痛
2023年2月
○
承認年月
公知
申請
2022年12月
○
承認年月
公知
申請
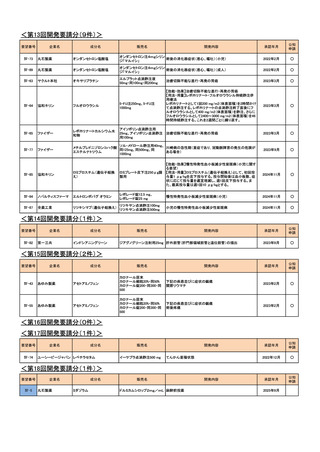
<第16回開発要請分(0件)>
<第17回開発要請分(1件)>
要望番号
Ⅳ-74
企業名
成分名
ユーシービージャパン レベチラセタム
販売名
イーケプラ点滴静注500 mg
開発内容
てんかん重積状態
<第18回開発要請分(1件)>
要望番号
Ⅳ-5
企業名
丸石製薬
成分名
ミダゾラム
販売名
ドルミカムシロップ2mg/mL 麻酔前投薬
開発内容
2025年9月
要望番号
企業名
成分名
販売名
開発内容
承認年月
公知
申請
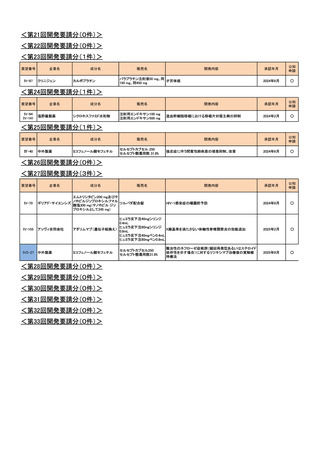
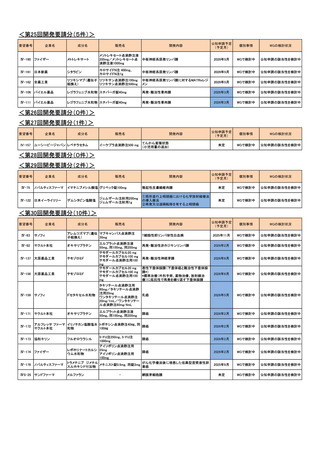
Ⅳ-73
丸石製薬
オンダンセトロン塩酸塩
オンダンセトロン注4mgシリン
術後の消化器症状(悪心、嘔吐)(小児)
ジ「マルイシ」
2022年2月
○
Ⅳ-89
丸石製薬
オンダンセトロン塩酸塩
オンダンセトロン注4mgシリン
術後の消化器症状(悪心、嘔吐)(成人)
ジ「マルイシ」
2022年2月
○
Ⅳ-63
ヤクルト本社
オキサリプラチン
エルプラット点滴静注液
50mg・同100mg・同200mg
治癒切除不能な進行・再発の胃癌
2023年3月
○
【効能・効果】治癒切除不能な進行・再発の胃癌
【用法・用量】レボホリナート・フルオロウラシル持続静注併
用療法
レボホリナートとして1回200 mg/m2(体表面積)を2時間かけ
て点滴静注する。レボホリナートの点滴静注終了直後にフ
ルオロウラシルとして400 mg/m2(体表面積)を静注、さらに
フルオロウラシルとして2400~3000 mg/m2(体表面積)を46
時間持続静注する。これを2週間ごとに繰り返す。
2023年3月
○
2023年3月
○
Ⅳ-64
協和キリン
フルオロウラシル
5-FU注250mg、5-FU注
1000mg
Ⅳ-65
ファイザー
レボホリナートカルシウム水
和物
アイソボリン点滴静注用
25mg、アイソボリン点滴静注 治癒切除不能な進行・再発の胃癌
用100mg
Ⅳ-77
ファイザー
ソル・メドロール静注用40mg、
メチルプレドニゾロンコハク酸
川崎病の急性期(重症であり,冠動脈障害の発生の危険が
同125mg、同500mg、同
エステルナトリウム
ある場合)
1000mg
2023年9月
○
Ⅳ-85
協和キリン
ロミプロスチム(遺伝子組換
え)
ロミプレート皮下注250μg調
製用
【効能・効果】慢性特発性血小板減少性紫斑病(小児に関す
る要望)
【用法・用量】ロミプロスチム(遺伝子組換え)として、初回投
与量1 μg/kgを皮下投与する。投与開始後は血小板数、症
状に応じて投与量を適宜増減し、週1回皮下投与する。ま
た、最高投与量は週1回10 μg/kgとする。
2024年11月
○
Ⅳ-84
ノバルティスファーマ
エルトロンボパグ オラミン
レボレード錠12.5 mg、
レボレード錠25 mg
慢性特発性血小板減少性紫斑病(小児)
2024年11月
○
Ⅳ-87
全薬工業
リツキシマブ(遺伝子組換え)
リツキサン点滴静注100mg
リツキサン点滴静注500mg
小児の慢性特発性血小板減少性紫斑病
2024年11月
○
承認年月
公知
申請
2023年9月
○
承認年月
公知
申請
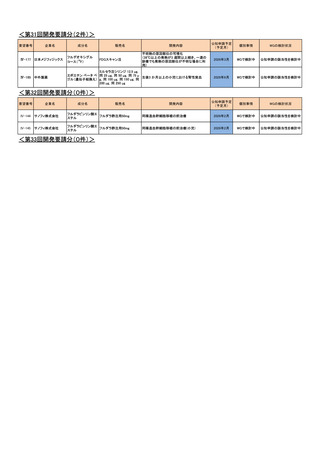
<第14回開発要請分(1件)>
要望番号
Ⅳ-82
企業名
第一三共
成分名
インドシアニングリーン
販売名
開発内容
ジアグノグリーン注射用25mg 肝外胆管(肝門部領域胆管と遠位胆管)の描出
<第15回開発要請分(2件)>
要望番号
Ⅳ-43
Ⅳ-55
企業名
あゆみ製薬
あゆみ製薬
成分名
販売名
開発内容
アセトアミノフェン
カロナール原末
カロナール細粒20%・同50%
カロナール錠200・同300・同
500
下記の疾患並びに症状の鎮痛
関節リウマチ
2023年2月
○
アセトアミノフェン
カロナール原末
カロナール細粒20%・同50%
カロナール錠200・同300・同
500
下記の疾患並びに症状の鎮痛
術後疼痛
2023年2月
○
承認年月
公知
申請
2022年12月
○
承認年月
公知
申請
<第16回開発要請分(0件)>
<第17回開発要請分(1件)>
要望番号
Ⅳ-74
企業名
成分名
ユーシービージャパン レベチラセタム
販売名
イーケプラ点滴静注500 mg
開発内容
てんかん重積状態
<第18回開発要請分(1件)>
要望番号
Ⅳ-5
企業名
丸石製薬
成分名
ミダゾラム
販売名
ドルミカムシロップ2mg/mL 麻酔前投薬
開発内容
2025年9月