よむ、つかう、まなぶ。
資料7-6 企業から提出された開発工程表の概要等(第Ⅳ回要望) [336KB] (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
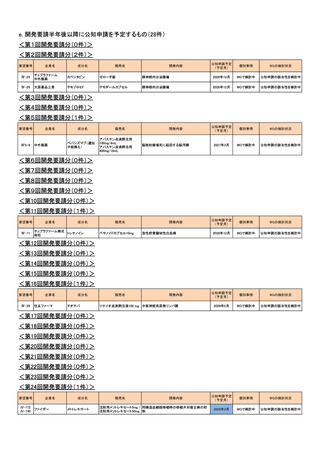
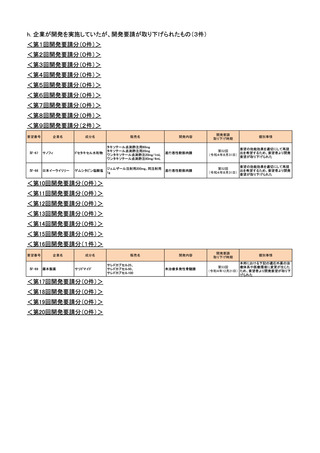
h. 企業が開発を実施していたが、開発要請が取り下げられたもの(3件)
<第1回開発要請分(0件)>
<第2回開発要請分(0件)>
<第3回開発要請分(0件)>
<第4回開発要請分(0件)>
<第5回開発要請分(0件)>
<第6回開発要請分(0件)>
<第7回開発要請分(0件)>
<第8回開発要請分(0件)>
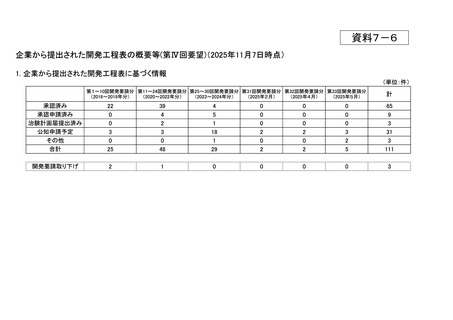
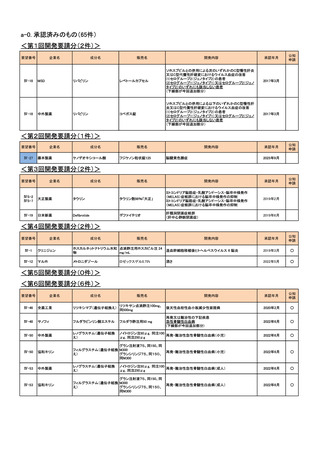
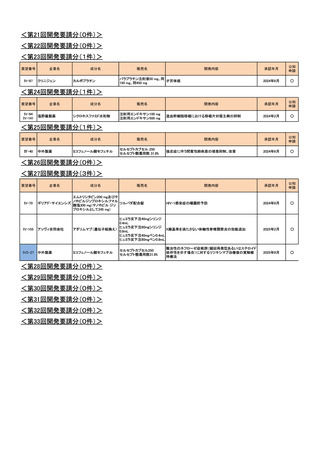
<第9回開発要請分(2件)>
要望番号
企業名
販売名
進行悪性軟部肉腫
要望の効能効果を適切にして再提
第52回
出を希望するため、要望者より開発
(令和4年8月31日)
要望が取り下げられた
進行悪性軟部肉腫
要望の効能効果を適切にして再提
第52回
出を希望するため、要望者より開発
(令和4年8月31日)
要望が取り下げられた
Ⅳ-67
サノフィ
ドセタキセル水和物
タキソテール点滴静注用80mg
タキソテール点滴静注用20mg
ワンタキソテール点滴静注20mg/1mL
ワンタキソテール点滴静注80mg/4mL
Ⅳ-68
日本イーライリリー
ゲムシタビン塩酸塩
ジェムザール注射用200mg、同注射用
1g
開発内容
開発要請
取り下げ時期
成分名
個別事情
<第10回開発要請分(0件)>
<第11回開発要請分(0件)>
<第12回開発要請分(0件)>
<第13回開発要請分(0件)>
<第14回開発要請分(0件)>
<第15回開発要請分(0件)>
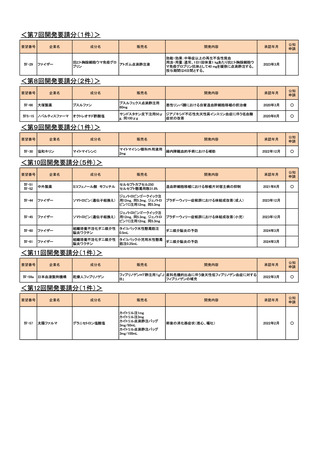
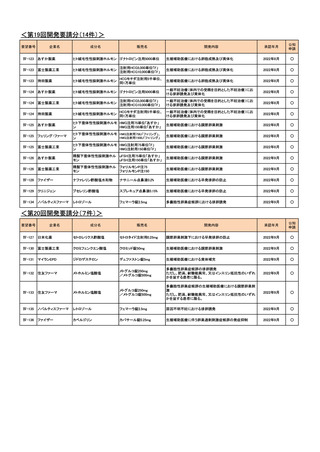
<第16回開発要請分(1件)>
要望番号
Ⅳ-69
企業名
藤本製薬
成分名
サリドマイド
<第17回開発要請分(0件)>
<第18回開発要請分(0件)>
<第19回開発要請分(0件)>
<第20回開発要請分(0件)>
販売名
サレドカプセル25、
サレドカプセル50、
サレドカプセル100
開発内容
未治療多発性骨髄腫
開発要請
取り下げ時期
個別事情
本邦における下記の適応外薬の治
第53回
療体系や医療環境に変更が生じた
(令和4年12月21日) ため、要望者より開発要望が取り下
げられた
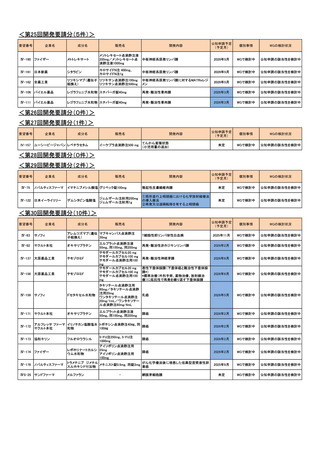
<第1回開発要請分(0件)>
<第2回開発要請分(0件)>
<第3回開発要請分(0件)>
<第4回開発要請分(0件)>
<第5回開発要請分(0件)>
<第6回開発要請分(0件)>
<第7回開発要請分(0件)>
<第8回開発要請分(0件)>
<第9回開発要請分(2件)>
要望番号
企業名
販売名
進行悪性軟部肉腫
要望の効能効果を適切にして再提
第52回
出を希望するため、要望者より開発
(令和4年8月31日)
要望が取り下げられた
進行悪性軟部肉腫
要望の効能効果を適切にして再提
第52回
出を希望するため、要望者より開発
(令和4年8月31日)
要望が取り下げられた
Ⅳ-67
サノフィ
ドセタキセル水和物
タキソテール点滴静注用80mg
タキソテール点滴静注用20mg
ワンタキソテール点滴静注20mg/1mL
ワンタキソテール点滴静注80mg/4mL
Ⅳ-68
日本イーライリリー
ゲムシタビン塩酸塩
ジェムザール注射用200mg、同注射用
1g
開発内容
開発要請
取り下げ時期
成分名
個別事情
<第10回開発要請分(0件)>
<第11回開発要請分(0件)>
<第12回開発要請分(0件)>
<第13回開発要請分(0件)>
<第14回開発要請分(0件)>
<第15回開発要請分(0件)>
<第16回開発要請分(1件)>
要望番号
Ⅳ-69
企業名
藤本製薬
成分名
サリドマイド
<第17回開発要請分(0件)>
<第18回開発要請分(0件)>
<第19回開発要請分(0件)>
<第20回開発要請分(0件)>
販売名
サレドカプセル25、
サレドカプセル50、
サレドカプセル100
開発内容
未治療多発性骨髄腫
開発要請
取り下げ時期
個別事情
本邦における下記の適応外薬の治
第53回
療体系や医療環境に変更が生じた
(令和4年12月21日) ため、要望者より開発要望が取り下
げられた