よむ、つかう、まなぶ。
資料6 山口光峰 医薬品医療機器総合機構医療情報科学部長 提出資料 (2 ページ)
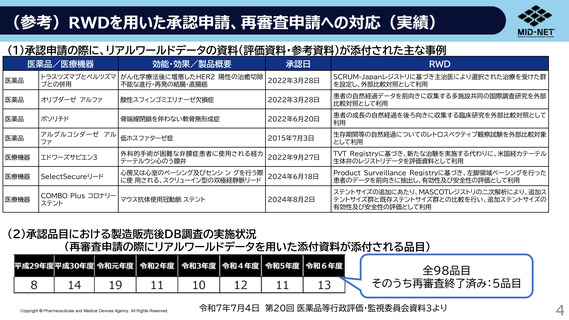
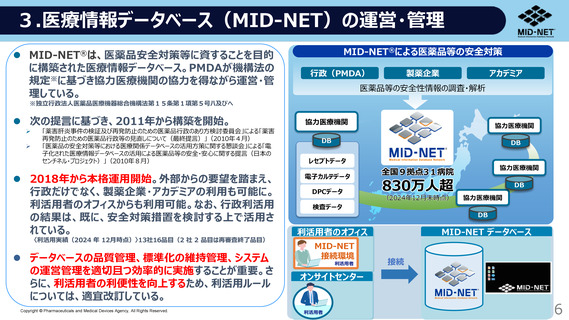
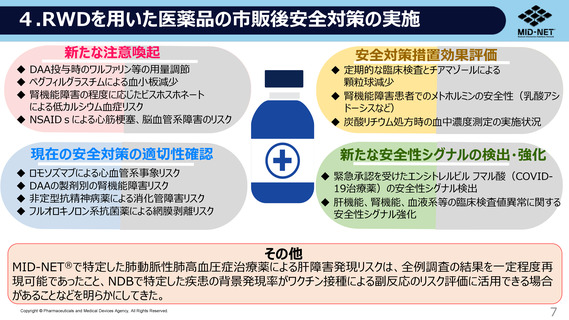
出典
| 公開元URL | https://www8.cao.go.jp/iryou/studygloup/20251014/agenda.html |
| 出典情報 | 医療等情報の利活用の推進に関する検討会(第4回 10/14)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
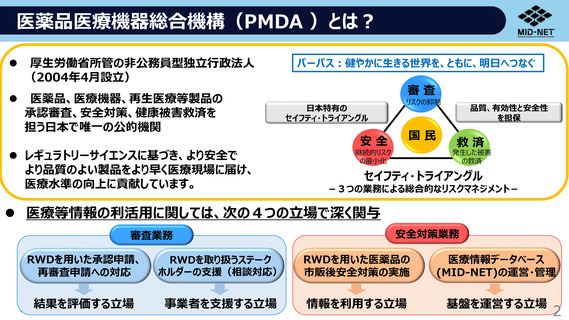
医薬品医療機器総合機構(PMDA )とは?
⚫
⚫
厚生労働省所管の非公務員型独立行政法人
(2004年4月設立)
医薬品、医療機器、再生医療等製品の
承認審査、安全対策、健康被害救済を
担う日本で唯一の公的機関
パーパス:健やかに生きる世界を、ともに、明日へつなぐ
審査
日本特有の
セイフティ・トライアングル
リスクの抑制
国民
安全
⚫ レギュラトリーサイエンスに基づき、より安全で
より品質のよい製品をより早く医療現場に届け、
医療水準の向上に貢献しています。
継続的リスク
の最小化
品質、有効性と安全性
を担保
救済
発生した被害
の救済
セイフティ・トライアングル
-3つの業務による総合的なリスクマネジメント-
⚫ 医療等情報の利活用に関しては、次の4つの立場で深く関与
審査業務
安全対策業務
RWDを用いた承認申請、
再審査申請への対応
RWDを取り扱うステーク
ホルダーの支援(相談対応)
RWDを用いた医薬品の
市販後安全対策の実施
医療情報データベース
(MID-NET)の運営・管理
結果を評価する立場
事業者を支援する立場
情報を利用する立場
基盤を運営する立場
Copyright © Pharmaceuticals and Medical Devices Agency, All Rights Reserved.
2
⚫
⚫
厚生労働省所管の非公務員型独立行政法人
(2004年4月設立)
医薬品、医療機器、再生医療等製品の
承認審査、安全対策、健康被害救済を
担う日本で唯一の公的機関
パーパス:健やかに生きる世界を、ともに、明日へつなぐ
審査
日本特有の
セイフティ・トライアングル
リスクの抑制
国民
安全
⚫ レギュラトリーサイエンスに基づき、より安全で
より品質のよい製品をより早く医療現場に届け、
医療水準の向上に貢献しています。
継続的リスク
の最小化
品質、有効性と安全性
を担保
救済
発生した被害
の救済
セイフティ・トライアングル
-3つの業務による総合的なリスクマネジメント-
⚫ 医療等情報の利活用に関しては、次の4つの立場で深く関与
審査業務
安全対策業務
RWDを用いた承認申請、
再審査申請への対応
RWDを取り扱うステーク
ホルダーの支援(相談対応)
RWDを用いた医薬品の
市販後安全対策の実施
医療情報データベース
(MID-NET)の運営・管理
結果を評価する立場
事業者を支援する立場
情報を利用する立場
基盤を運営する立場
Copyright © Pharmaceuticals and Medical Devices Agency, All Rights Reserved.
2