よむ、つかう、まなぶ。
特定細胞加工物の微生物学的安全性に関する指針案について[1.3MB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_63117.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第110回 9/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
特定細胞加工物の微生物学的安全性に関する指針について(案)
1. はじめに(特定細胞加工物を用いた再生医療等技術における安全性確保について)
•
•
滅菌工程の適用が不可能な特定細胞加工物の提供における安全性確保では、細菌や真菌、ウイル
スなど微生物汚染による感染症への対策が最も重要な課題の一つである。
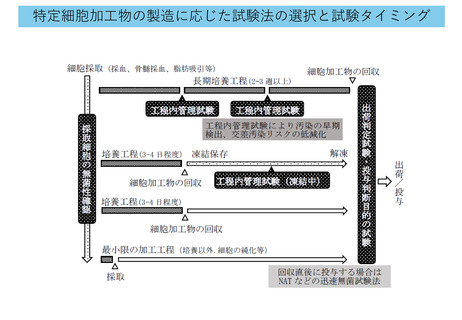
特定細胞加工物の製造工程での汚染の防止や特定細胞加工物の無菌性を担保する試験(無菌試
験)を実施するなど、十分な安全対策が求められる。
2. 特定細胞加工物の微生物学的安全性の考え方について
•
再生医療等に用いる特定細胞加工物の微生物汚染を防止するためには、以下の一連の過程におい
てリスク管理策を講じる必要がある。
I. 細胞の採取
• 細胞の採取方法に応じた無菌的採取
II. 特定細胞加工物の製造
• 細胞培養加工従事者の無菌操作等の技術の習熟と教育
• 製造工程の管理
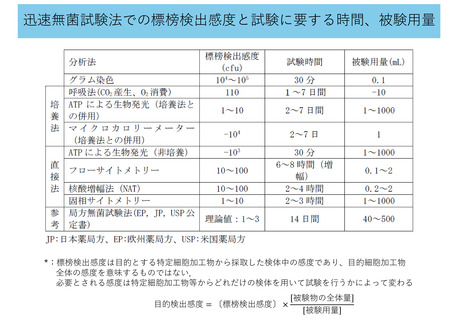
• 無菌性の確認試験の実施(工程内管理試験や提供の可否を判断するための試験)
• 環境モニタリングと清掃・消毒
III. 輸送
• 細胞を採取した施設から特定細胞加工物を製造する施設(CPC)への輸送
• 特定細胞加工物のCPCから医療機関への輸送
IV. 医療機関での投与
• 医療機関での保管(有効期間)
5
• 投与における清潔操作
1. はじめに(特定細胞加工物を用いた再生医療等技術における安全性確保について)
•
•
滅菌工程の適用が不可能な特定細胞加工物の提供における安全性確保では、細菌や真菌、ウイル
スなど微生物汚染による感染症への対策が最も重要な課題の一つである。
特定細胞加工物の製造工程での汚染の防止や特定細胞加工物の無菌性を担保する試験(無菌試
験)を実施するなど、十分な安全対策が求められる。
2. 特定細胞加工物の微生物学的安全性の考え方について
•
再生医療等に用いる特定細胞加工物の微生物汚染を防止するためには、以下の一連の過程におい
てリスク管理策を講じる必要がある。
I. 細胞の採取
• 細胞の採取方法に応じた無菌的採取
II. 特定細胞加工物の製造
• 細胞培養加工従事者の無菌操作等の技術の習熟と教育
• 製造工程の管理
• 無菌性の確認試験の実施(工程内管理試験や提供の可否を判断するための試験)
• 環境モニタリングと清掃・消毒
III. 輸送
• 細胞を採取した施設から特定細胞加工物を製造する施設(CPC)への輸送
• 特定細胞加工物のCPCから医療機関への輸送
IV. 医療機関での投与
• 医療機関での保管(有効期間)
5
• 投与における清潔操作