よむ、つかう、まなぶ。
資料1-1 厚生労働省 御提出資料 (16 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2310_04medical/240328/medical09_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第9回 3/28)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
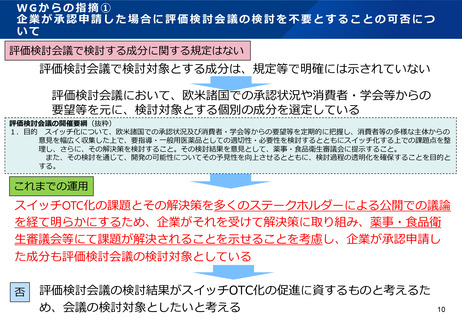
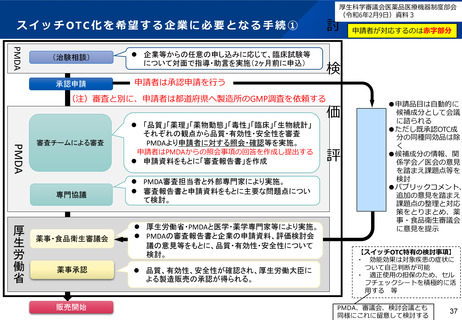
WGからの指摘④-3
「審査」や「承認の可否判断」とは具体的にどのような業務を行っているの
か。また、専門家がどのようにその業務に知見を活かしているのか
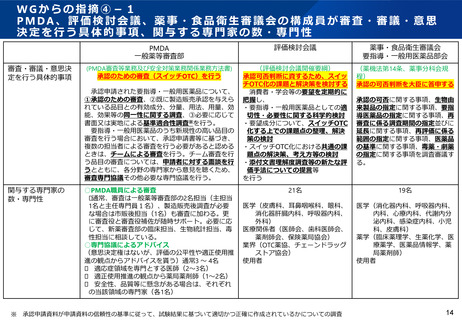
<専門的知見> 医学・薬学
●審査について
提出された申請資料等に基づき、規格及び試験方法、安定性、有効性、安全性、効能・効果、用
法・用量、使用上の注意、適正使用の方策(情報提供資材、包装単位)等に問題はないかを、同一
成分の副作用の発生状況、申請された用法用量、海外での一般用医薬品としての使用状況、再審査
の結果等も踏まえて科学的に検討し、また、適正使用と安全性確保の方策として製造販売後調査の
実施(情報提供の方法、販売方法等を含む)が適切になされるよう必要に応じて条件を提案する形
で、審査報告書を作成する。
<専門的知見> 医学・薬学、使用者
●承認の可否判断について
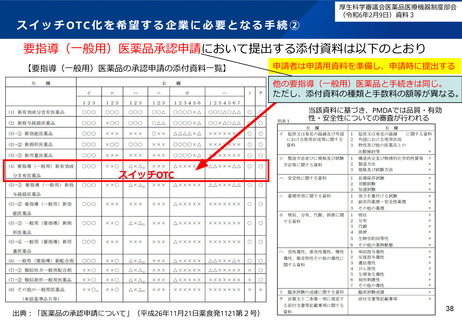
申請企業の提出した資料、PMDAが作成した審査報告書等を元に、当該申請品目について要指導
(一般用)新有効成分含有医薬品としての薬機法第14条第2項(注1:承認拒否事由)への該当性に
ついて、薬事・食品衛生審議会要指導・一般用医薬品部会にて審議し、承認の可否判断についての
議決を行う。
(注1) ・ 申請に係る医薬品がその申請に係る効能又は効果を有すると認められないとき
・ 申請に係る医薬品がその効能又は効果に比して著しく有害な作用を有することにより使用価値がないと認められるとき
・ 製造所における製造管理又は品質管理の方法が基準に適合していると認められないとき 等
<専門的知見> 医学・薬学、医療関係者、販売者、業界、使用者
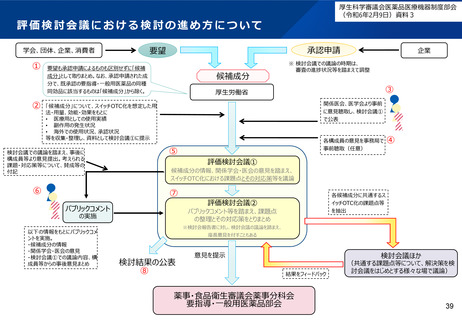
●スイッチOTC化の課題と解決策の検討について
要望成分について、医療用としての使用実績、副作用の発生状況、海外での使用状況等の資料を
元に、スイッチOTC化の課題の抽出を行い、評価検討会議において関係医会・医学会のヒアリング
を実施して構成員にて意見交換を行うことにより、当該課題の解決策を検討し、パブリックコメン
トを経て、スイッチOTC化の課題と解決策を取りまとめて公表するとともに薬事・食品衛生審議会
に報告する。
(注2)なお、審査、審議等の内容は、平易にかみ砕いた記載としていることに留意が必要
16
「審査」や「承認の可否判断」とは具体的にどのような業務を行っているの
か。また、専門家がどのようにその業務に知見を活かしているのか
<専門的知見> 医学・薬学
●審査について
提出された申請資料等に基づき、規格及び試験方法、安定性、有効性、安全性、効能・効果、用
法・用量、使用上の注意、適正使用の方策(情報提供資材、包装単位)等に問題はないかを、同一
成分の副作用の発生状況、申請された用法用量、海外での一般用医薬品としての使用状況、再審査
の結果等も踏まえて科学的に検討し、また、適正使用と安全性確保の方策として製造販売後調査の
実施(情報提供の方法、販売方法等を含む)が適切になされるよう必要に応じて条件を提案する形
で、審査報告書を作成する。
<専門的知見> 医学・薬学、使用者
●承認の可否判断について
申請企業の提出した資料、PMDAが作成した審査報告書等を元に、当該申請品目について要指導
(一般用)新有効成分含有医薬品としての薬機法第14条第2項(注1:承認拒否事由)への該当性に
ついて、薬事・食品衛生審議会要指導・一般用医薬品部会にて審議し、承認の可否判断についての
議決を行う。
(注1) ・ 申請に係る医薬品がその申請に係る効能又は効果を有すると認められないとき
・ 申請に係る医薬品がその効能又は効果に比して著しく有害な作用を有することにより使用価値がないと認められるとき
・ 製造所における製造管理又は品質管理の方法が基準に適合していると認められないとき 等
<専門的知見> 医学・薬学、医療関係者、販売者、業界、使用者
●スイッチOTC化の課題と解決策の検討について
要望成分について、医療用としての使用実績、副作用の発生状況、海外での使用状況等の資料を
元に、スイッチOTC化の課題の抽出を行い、評価検討会議において関係医会・医学会のヒアリング
を実施して構成員にて意見交換を行うことにより、当該課題の解決策を検討し、パブリックコメン
トを経て、スイッチOTC化の課題と解決策を取りまとめて公表するとともに薬事・食品衛生審議会
に報告する。
(注2)なお、審査、審議等の内容は、平易にかみ砕いた記載としていることに留意が必要
16