よむ、つかう、まなぶ。
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (8 ページ)
出典
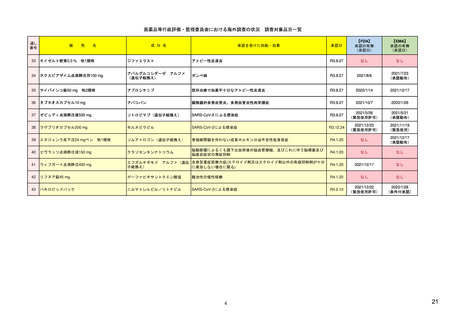
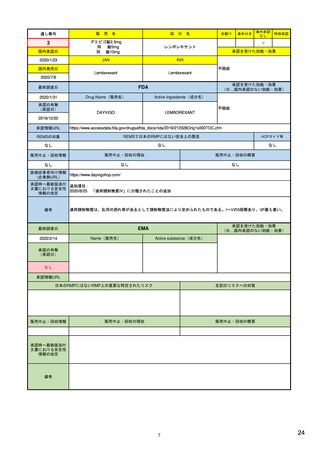
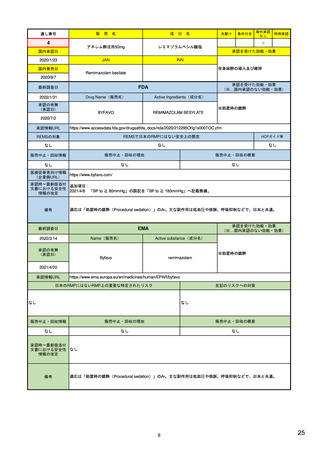
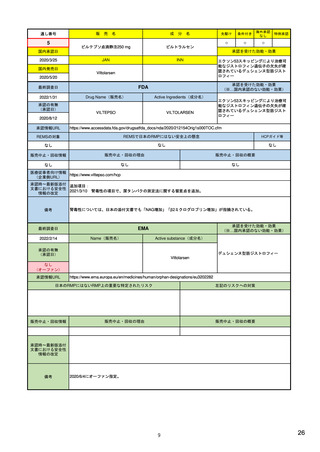
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
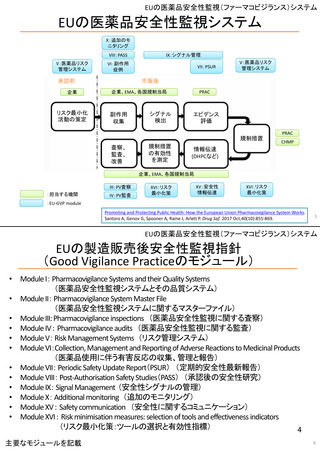
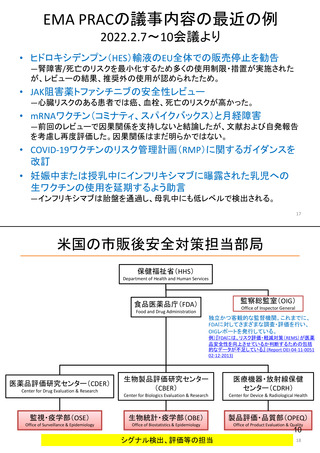
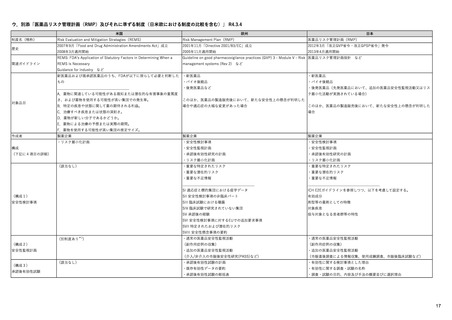
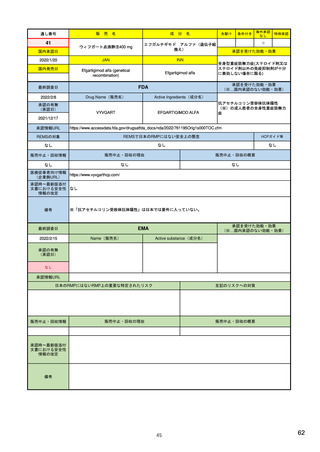
米国の医薬品安全性監視(ファーマコビジランス)システム
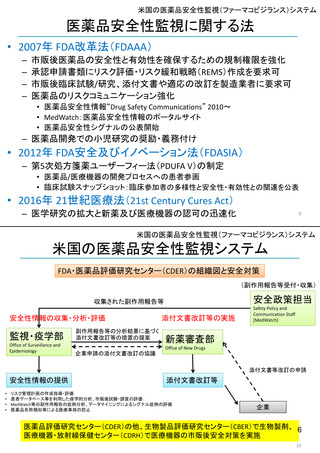
FDA: Postmarket Drug and Biologic Safety
Evaluations (市販後医薬品安全性評価)
• 2007年9月27日以降にNDA(New Drug Applications:新薬承
認申請)およびBLA(Biologic License Applications:生物製剤承
認申請)の承認を受けた医薬品が対象
• 製品が承認後に広く一般に使用された後
‒ 開発段階では特定されなかった新たな重篤な有害事象
‒ 既知であるが通常より報告数が多い副作用
‒ 新たな安全性の懸念
が生じていないか明らかにする。
• 医薬品の承認後18カ月、または使用者が1万人に達した時点の
いずれか遅い方で実施
• 2017年9月までで終了。理由は、他の監視活動と重複する、リソース
が有効に活用されていない、希少疾患用医薬品の多くは評価開始の
基準である使用者1万人という条件を満たせず柔軟性に欠ける、等
<FDAAA 2007 Section 915>
13
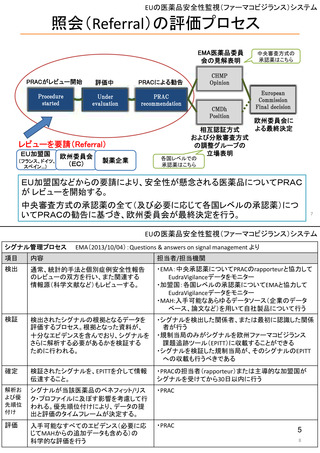
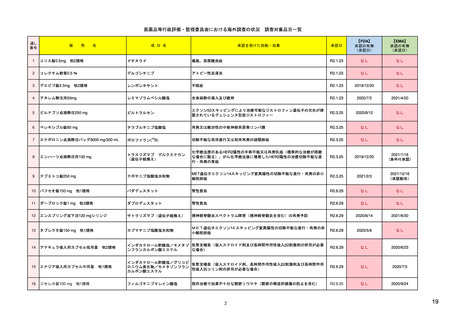
1. 市販後安全対策に関連する安全性の評価及び
イ
措置の検討を行う会議体
(具体的な議題内容の最近の例を含む)
8
14
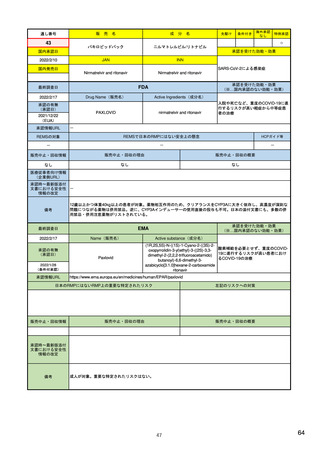
FDA: Postmarket Drug and Biologic Safety
Evaluations (市販後医薬品安全性評価)
• 2007年9月27日以降にNDA(New Drug Applications:新薬承
認申請)およびBLA(Biologic License Applications:生物製剤承
認申請)の承認を受けた医薬品が対象
• 製品が承認後に広く一般に使用された後
‒ 開発段階では特定されなかった新たな重篤な有害事象
‒ 既知であるが通常より報告数が多い副作用
‒ 新たな安全性の懸念
が生じていないか明らかにする。
• 医薬品の承認後18カ月、または使用者が1万人に達した時点の
いずれか遅い方で実施
• 2017年9月までで終了。理由は、他の監視活動と重複する、リソース
が有効に活用されていない、希少疾患用医薬品の多くは評価開始の
基準である使用者1万人という条件を満たせず柔軟性に欠ける、等
<FDAAA 2007 Section 915>
13
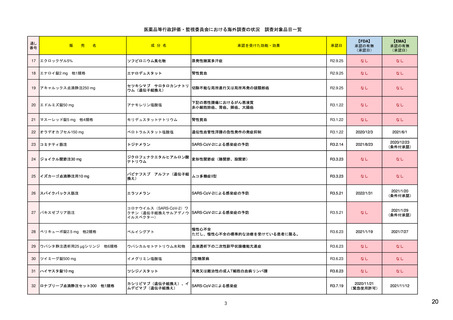
1. 市販後安全対策に関連する安全性の評価及び
イ
措置の検討を行う会議体
(具体的な議題内容の最近の例を含む)
8
14