よむ、つかう、まなぶ。
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
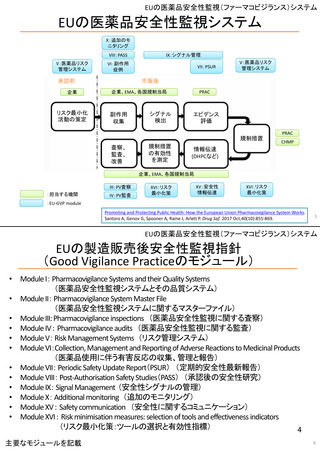
米国の医薬品安全性監視(ファーマコビジランス)システム
医薬品安全性監視に関する法
• 2007年 FDA改革法(FDAAA)
–
–
–
–
市販後医薬品の安全性と有効性を確保するための規制権限を強化
承認申請書類にリスク評価・リスク緩和戦略(REMS)作成を要求可
市販後臨床試験/研究、添付文書や適応の改訂を製造業者に要求可
医薬品のリスクコミュニケーション強化
• 医薬品安全性情報“Drug Safety Communications” 2010~
• MedWatch:医薬品安全性情報のポータルサイト
• 医薬品安全性シグナルの公表開始
– 医薬品開発での小児研究の奨励・義務付け
• 2012年 FDA安全及びイノベーション法(FDASIA)
– 第5次処方箋薬ユーザーフィー法(PDUFA V)の制定
• 医薬品/医療機器の開発プロセスへの患者参画
• 臨床試験スナップショット:臨床参加者の多様性と安全性・有効性との関連を公表
• 2016年 21世紀医療法(21st Century Cures Act)
– 医学研究の拡大と新薬及び医療機器の認可の迅速化
9
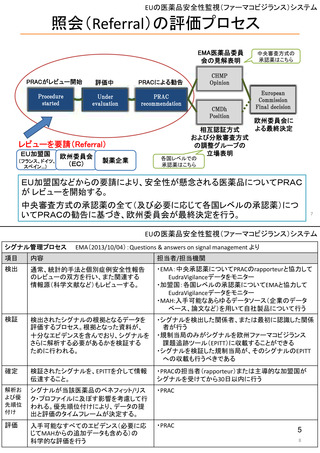
米国の医薬品安全性監視(ファーマコビジランス)システム
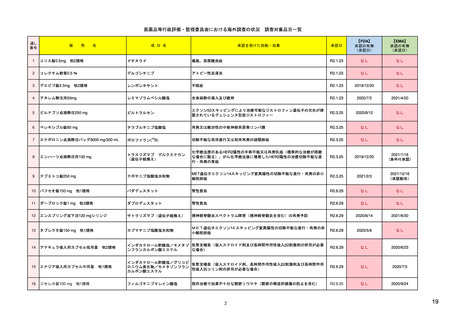
米国の医薬品安全性監視システム
FDA・医薬品評価研究センター(CDER)の組織図と安全対策
(副作用報告等受付・収集)
安全政策担当
収集された副作用報告等
安全性情報の収集・分析・評価
監視・疫学部
副作用報告等の分析結果に基づく
添付文書改訂等の措置の提案
Office of Surveillance and
Epidemiology
企業申請の添付文書改訂の協議
添付文書改訂等の実施
Safety Policy and
Communication Staff
[MedWatch]
新薬審査部
Office of New Drugs
添付文書等改訂の申請
安全性情報の提供
•
•
•
•
添付文書改訂等
リスク管理計画の作成指導・評価
患者データベース等を利用した疫学的分析、市販後試験・調査の評価
MedWatch等の副作用報告の症例分析、データマイニングによるシグナル症例の評価
医薬品名称類似等による医療事故の防止
企業
医薬品評価研究センター(CDER)の他、生物製品評価研究センター(CBER)で生物製剤、 6
医療機器・放射線保健センター(CDRH)で医療機器の市販後安全対策を実施
10
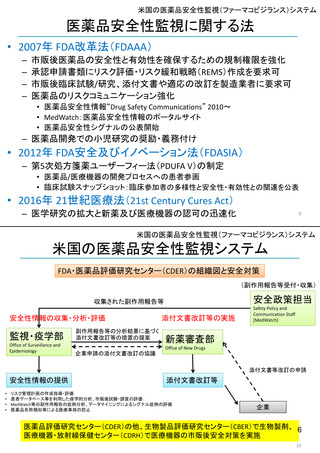
医薬品安全性監視に関する法
• 2007年 FDA改革法(FDAAA)
–
–
–
–
市販後医薬品の安全性と有効性を確保するための規制権限を強化
承認申請書類にリスク評価・リスク緩和戦略(REMS)作成を要求可
市販後臨床試験/研究、添付文書や適応の改訂を製造業者に要求可
医薬品のリスクコミュニケーション強化
• 医薬品安全性情報“Drug Safety Communications” 2010~
• MedWatch:医薬品安全性情報のポータルサイト
• 医薬品安全性シグナルの公表開始
– 医薬品開発での小児研究の奨励・義務付け
• 2012年 FDA安全及びイノベーション法(FDASIA)
– 第5次処方箋薬ユーザーフィー法(PDUFA V)の制定
• 医薬品/医療機器の開発プロセスへの患者参画
• 臨床試験スナップショット:臨床参加者の多様性と安全性・有効性との関連を公表
• 2016年 21世紀医療法(21st Century Cures Act)
– 医学研究の拡大と新薬及び医療機器の認可の迅速化
9
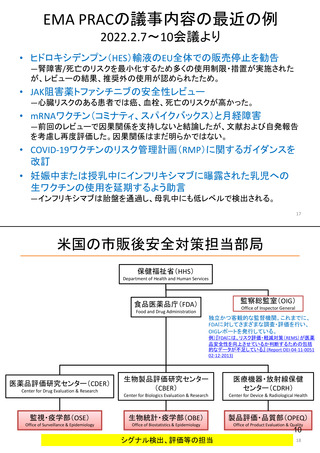
米国の医薬品安全性監視(ファーマコビジランス)システム
米国の医薬品安全性監視システム
FDA・医薬品評価研究センター(CDER)の組織図と安全対策
(副作用報告等受付・収集)
安全政策担当
収集された副作用報告等
安全性情報の収集・分析・評価
監視・疫学部
副作用報告等の分析結果に基づく
添付文書改訂等の措置の提案
Office of Surveillance and
Epidemiology
企業申請の添付文書改訂の協議
添付文書改訂等の実施
Safety Policy and
Communication Staff
[MedWatch]
新薬審査部
Office of New Drugs
添付文書等改訂の申請
安全性情報の提供
•
•
•
•
添付文書改訂等
リスク管理計画の作成指導・評価
患者データベース等を利用した疫学的分析、市販後試験・調査の評価
MedWatch等の副作用報告の症例分析、データマイニングによるシグナル症例の評価
医薬品名称類似等による医療事故の防止
企業
医薬品評価研究センター(CDER)の他、生物製品評価研究センター(CBER)で生物製剤、 6
医療機器・放射線保健センター(CDRH)で医療機器の市販後安全対策を実施
10