よむ、つかう、まなぶ。
【資料1-1】 医薬品等行政評価・監視委員会における海外調査の状況 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
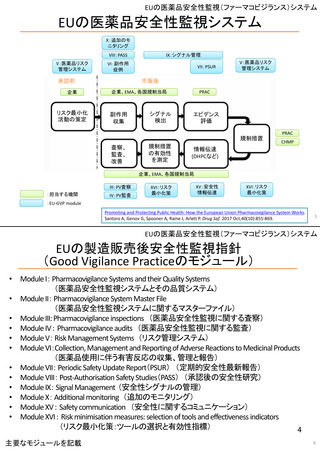
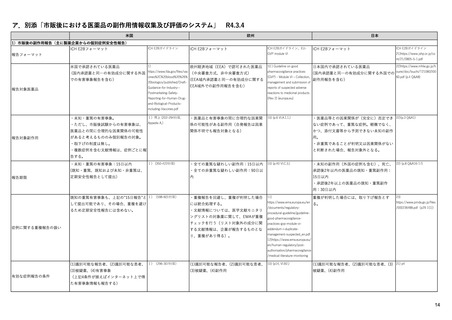
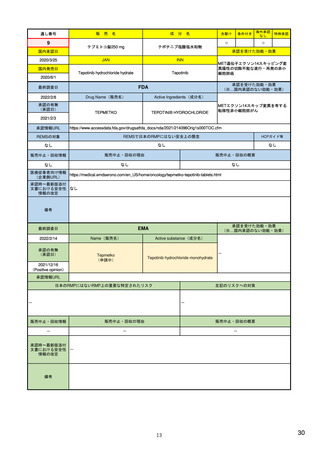
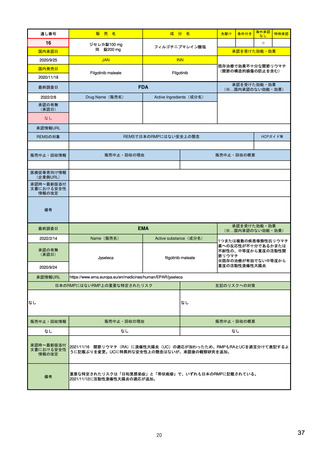
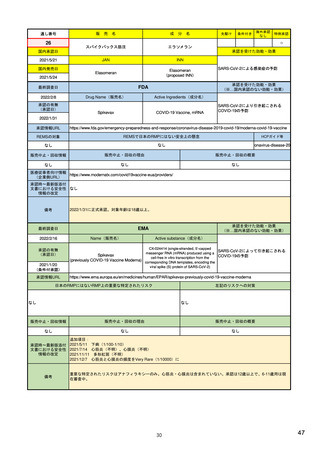
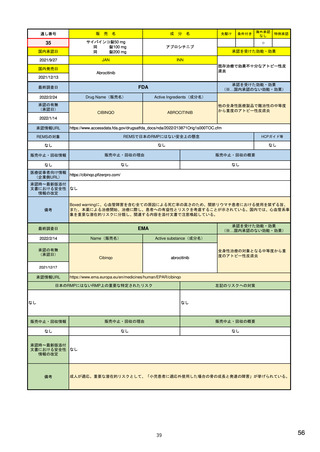
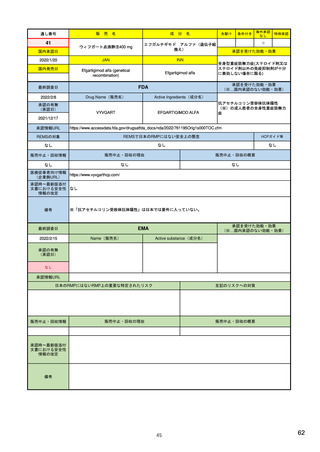
EUの医薬品安全性監視(ファーマコビジランス)システム
Referral照会(Referral)の評価プロセス
procedure
EMA医薬品委員
会の見解表明
PRACがレビュー開始
Procedure
started
評価中
PRACによる勧告
Under
evaluation
PRAC
recommendation
EU加盟国
(フランス、ドイツ、
スペイン…)
欧州委員会
(EC)
CHMP
Opinion
CMDh
Position
相互認証方式
および分散審査方式
の調整グループの
立場表明
レビューを要請(Referral)
中央審査方式の
承認薬はこちら
European
Commission
Final decision
欧州委員会に
よる最終決定
各国レベルでの
承認薬はこちら
製薬企業
EU加盟国などからの要請により、安全性が懸念される医薬品についてPRAC
が レビューを開始する。
中央審査方式の承認薬の全て(及び必要に応じて各国レベルの承認薬)につ
いてPRACの勧告に基づき、欧州委員会が最終決定を行う。
7
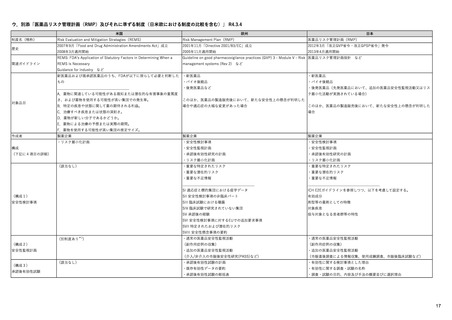
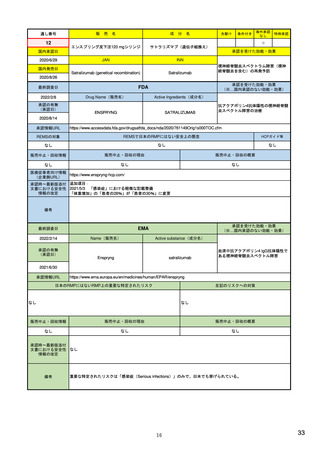
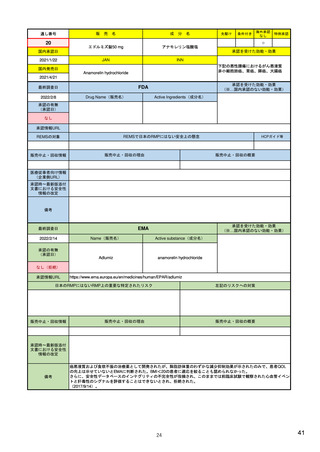
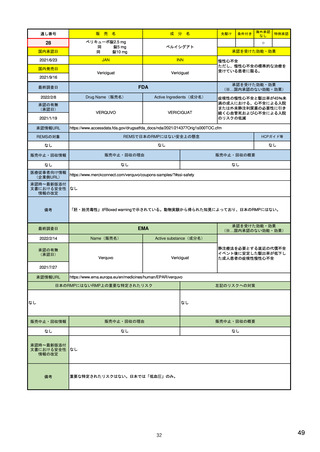
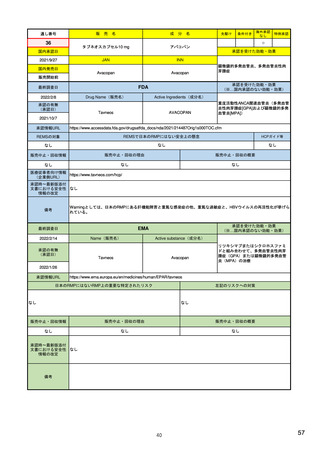
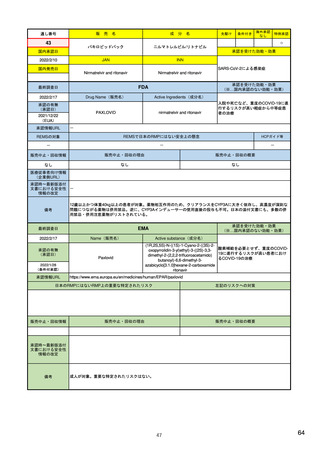
EUの医薬品安全性監視(ファーマコビジランス)システム
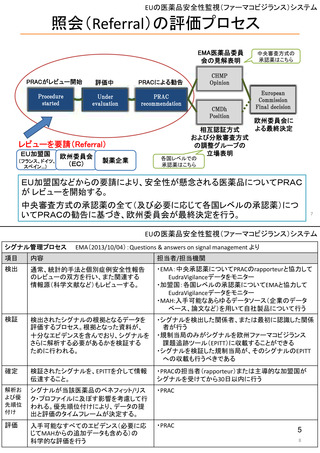
シグナル管理プロセス
EMA(2013/10/04):Questions & answers on signal management より
項目
内容
担当者/担当機関
検出
通常、統計的手法と個別症例安全性報告
のレビューの双方を行い、また関連する
情報源(科学文献など)もレビューする。
・EMA:中央承認薬についてPRACのrapporteurと協力して
EudraVigilanceデータをモニター
・加盟国:各国レベルの承認薬についてEMAと協力して
EudraVigilanceデータをモニター
・MAH:入手可能なあらゆるデータソース(企業のデータ
ベース、論文など)を用いて自社製品について行う
検証
検出されたシグナルの根拠となるデータを
評価するプロセス。根拠となった資料が、
十分なエビデンスを含んでおり、シグナルを
さらに解析する必要があるかを検証する
ために行われる。
・シグナルを検出した関係者、または最初に認識した関係
者が行う
・規制当局のみがシグナルを欧州ファーマコビジランス
課題追跡ツール(EPITT)に収載することができる
・シグナルを検証した規制当局が、そのシグナルのEPITT
への収載も行うべきである
確定
検証されたシグナルを、EPITTを介して情報
伝達すること。
・PRACの担当者(rapporteur)または主導的な加盟国が
シグナルを受けてから30日以内に行う
解析お
よび優
先順位
付け
シグナルが当該医薬品のベネフィット/リス
ク・プロファイルに及ぼす影響を考慮して行
われる。優先順位付けにより、データの提
出と評価のタイムフレームが決定する。
・PRAC
評価
入手可能なすべてのエビデンス(必要に応
じてMAHからの追加データも含める)の
科学的な評価を行う
・PRAC
5
8
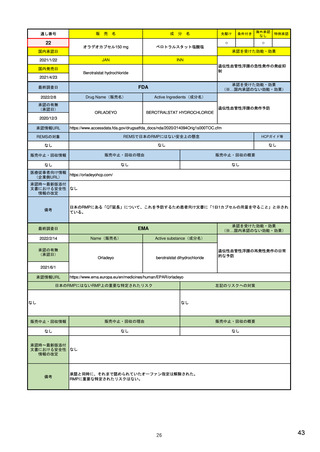
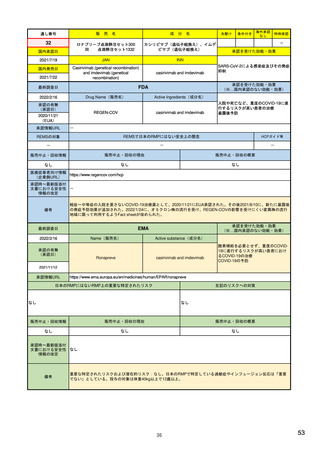
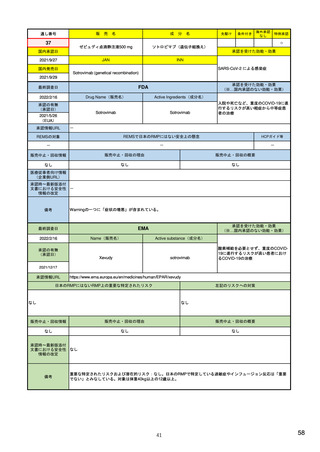
Referral照会(Referral)の評価プロセス
procedure
EMA医薬品委員
会の見解表明
PRACがレビュー開始
Procedure
started
評価中
PRACによる勧告
Under
evaluation
PRAC
recommendation
EU加盟国
(フランス、ドイツ、
スペイン…)
欧州委員会
(EC)
CHMP
Opinion
CMDh
Position
相互認証方式
および分散審査方式
の調整グループの
立場表明
レビューを要請(Referral)
中央審査方式の
承認薬はこちら
European
Commission
Final decision
欧州委員会に
よる最終決定
各国レベルでの
承認薬はこちら
製薬企業
EU加盟国などからの要請により、安全性が懸念される医薬品についてPRAC
が レビューを開始する。
中央審査方式の承認薬の全て(及び必要に応じて各国レベルの承認薬)につ
いてPRACの勧告に基づき、欧州委員会が最終決定を行う。
7
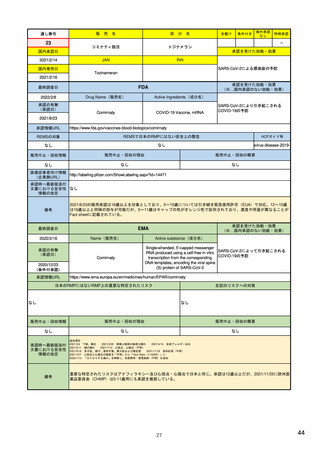
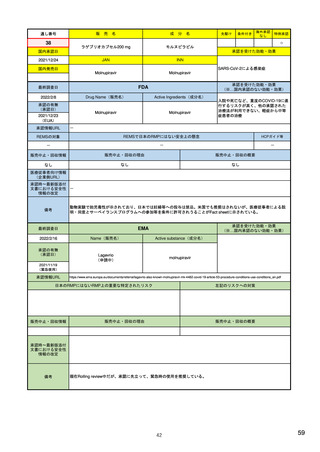
EUの医薬品安全性監視(ファーマコビジランス)システム
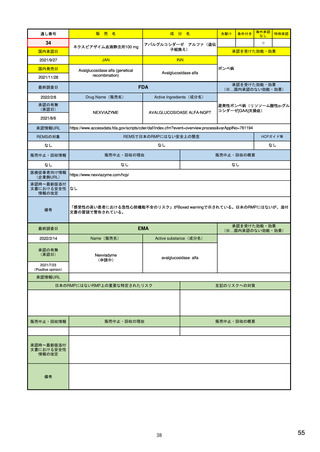
シグナル管理プロセス
EMA(2013/10/04):Questions & answers on signal management より
項目
内容
担当者/担当機関
検出
通常、統計的手法と個別症例安全性報告
のレビューの双方を行い、また関連する
情報源(科学文献など)もレビューする。
・EMA:中央承認薬についてPRACのrapporteurと協力して
EudraVigilanceデータをモニター
・加盟国:各国レベルの承認薬についてEMAと協力して
EudraVigilanceデータをモニター
・MAH:入手可能なあらゆるデータソース(企業のデータ
ベース、論文など)を用いて自社製品について行う
検証
検出されたシグナルの根拠となるデータを
評価するプロセス。根拠となった資料が、
十分なエビデンスを含んでおり、シグナルを
さらに解析する必要があるかを検証する
ために行われる。
・シグナルを検出した関係者、または最初に認識した関係
者が行う
・規制当局のみがシグナルを欧州ファーマコビジランス
課題追跡ツール(EPITT)に収載することができる
・シグナルを検証した規制当局が、そのシグナルのEPITT
への収載も行うべきである
確定
検証されたシグナルを、EPITTを介して情報
伝達すること。
・PRACの担当者(rapporteur)または主導的な加盟国が
シグナルを受けてから30日以内に行う
解析お
よび優
先順位
付け
シグナルが当該医薬品のベネフィット/リス
ク・プロファイルに及ぼす影響を考慮して行
われる。優先順位付けにより、データの提
出と評価のタイムフレームが決定する。
・PRAC
評価
入手可能なすべてのエビデンス(必要に応
じてMAHからの追加データも含める)の
科学的な評価を行う
・PRAC
5
8
関連画像
ページ内で利用されている画像ファイルです。
有料会員登録をして頂くことで、このページ内で利用されている画像を個別に閲覧・ダウンロードすることができるようになります。