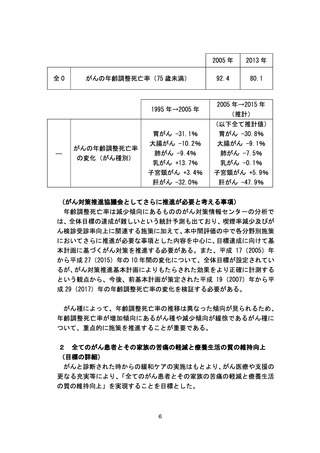
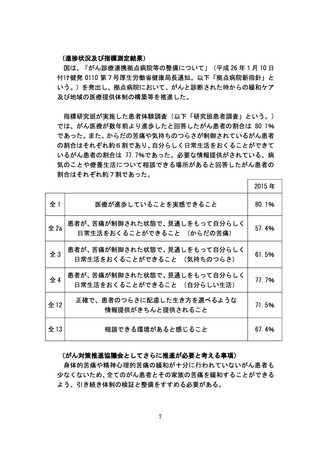
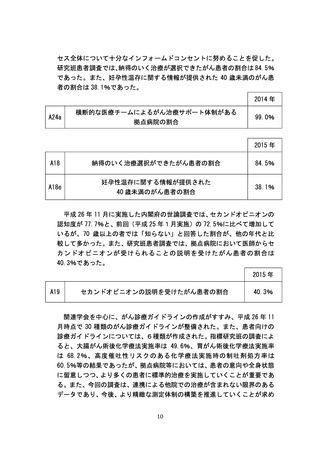
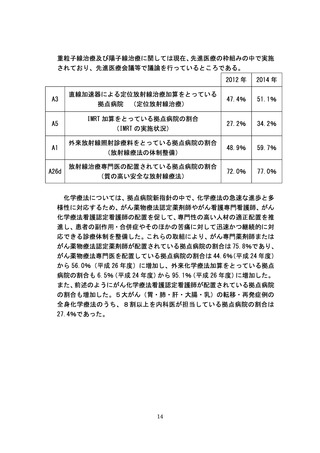
よむ、つかう、まなぶ。
参考資料3 がん対策推進基本計画中間評価報告書(平成27年6月) (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24471.html |
| 出典情報 | がん対策推進協議会(第78回 3/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
で安全な医薬品・医療機器を迅速に提供するための取組を着実に実施する
ことを目標とした。
(進捗状況及び指標測定結果)
厚生労働省では、平成 24 年度より「臨床研究品質確保体制整備事業」を
立ち上げ、日本発の革新的医薬品・医療機器の開発などに必要となる質の高
い臨床研究を推進するため、国際水準の臨床研究や医師主導治験を実施する
拠点施設に支援を行ってきた。平成 26 年6月に制定された「地域における
医療及び介護の総合的な確保を推進するための関係法律の整備等に関する
法律」により、これらの研究の中心的役割を担う医療機関として、「臨床研
究中核病院」が医療法上位置づけられ、平成 27 年4月から施行することと
された。平成 25 年度に実施されたがんの第Ⅰ相臨床試験は 85 件であり、第
Ⅲ相臨床試験は 79 件であった。
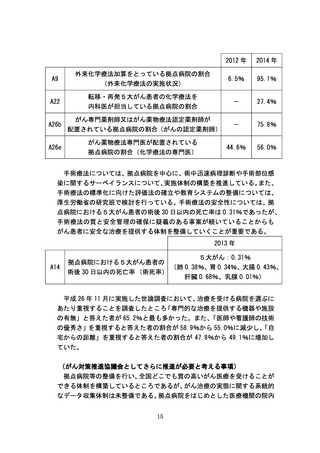
2013 年
B13a
がんの第Ⅰ相および III 相臨床試験の実施数
第Ⅰ相試験 85 件
第Ⅲ相試験 79 件
CRC(臨床研究コーディネーター)の育成については、平成23年度より
「臨床研究コーディネーター、データマネージャー確保のための研修事業」
において、研究の立案からデータのとりまとめまで幅広い知識と経験でサポ
ートできる上級者CRC等の育成を推進し、平成25年度に99名、平成26年度
に72名の上級者CRCを養成した。
また、厚生労働大臣が希少疾病用医薬品・医療機器として指定し、助成金
交付申請された医薬品・医療機器の開発については、PMDAが専門的な助
言・指導を実施している。PMDAでは、アカデミア・ベンチャー等による
優れたシーズを実用化につなげるため、平成 23 年7月から薬事戦略相談を
開始しており、平成 25 年 10 月からはPMDA関西支部においても本相談の
業務を開始し、体制強化を図ってきた。さらに、連携大学院協定に基づく人
材交流や厚生労働省の予算事業である「革新的医薬品・医療機器・再生医療
等製品実用化促進事業」に基づく人材交流により、先端的な創薬等に対応で
きる審査員の育成を推進している。指標研究班が実施した調査では、抗がん
剤開発のドラッグラグについて、平成 24 年度は申請ラグが 32.9 か月、審査
ラグが 1.6 か月であったが、平成 25 年度には申請ラグが 5.7 か月、審査ラ
グが0か月に短縮された。
24
ことを目標とした。
(進捗状況及び指標測定結果)
厚生労働省では、平成 24 年度より「臨床研究品質確保体制整備事業」を
立ち上げ、日本発の革新的医薬品・医療機器の開発などに必要となる質の高
い臨床研究を推進するため、国際水準の臨床研究や医師主導治験を実施する
拠点施設に支援を行ってきた。平成 26 年6月に制定された「地域における
医療及び介護の総合的な確保を推進するための関係法律の整備等に関する
法律」により、これらの研究の中心的役割を担う医療機関として、「臨床研
究中核病院」が医療法上位置づけられ、平成 27 年4月から施行することと
された。平成 25 年度に実施されたがんの第Ⅰ相臨床試験は 85 件であり、第
Ⅲ相臨床試験は 79 件であった。
2013 年
B13a
がんの第Ⅰ相および III 相臨床試験の実施数
第Ⅰ相試験 85 件
第Ⅲ相試験 79 件
CRC(臨床研究コーディネーター)の育成については、平成23年度より
「臨床研究コーディネーター、データマネージャー確保のための研修事業」
において、研究の立案からデータのとりまとめまで幅広い知識と経験でサポ
ートできる上級者CRC等の育成を推進し、平成25年度に99名、平成26年度
に72名の上級者CRCを養成した。
また、厚生労働大臣が希少疾病用医薬品・医療機器として指定し、助成金
交付申請された医薬品・医療機器の開発については、PMDAが専門的な助
言・指導を実施している。PMDAでは、アカデミア・ベンチャー等による
優れたシーズを実用化につなげるため、平成 23 年7月から薬事戦略相談を
開始しており、平成 25 年 10 月からはPMDA関西支部においても本相談の
業務を開始し、体制強化を図ってきた。さらに、連携大学院協定に基づく人
材交流や厚生労働省の予算事業である「革新的医薬品・医療機器・再生医療
等製品実用化促進事業」に基づく人材交流により、先端的な創薬等に対応で
きる審査員の育成を推進している。指標研究班が実施した調査では、抗がん
剤開発のドラッグラグについて、平成 24 年度は申請ラグが 32.9 か月、審査
ラグが 1.6 か月であったが、平成 25 年度には申請ラグが 5.7 か月、審査ラ
グが0か月に短縮された。
24