よむ、つかう、まなぶ。
資料3 令和5年度補正予算案について(報告) (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000210433_00051.html |
| 出典情報 | 社会保障審議会 医療部会(第104回 11/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
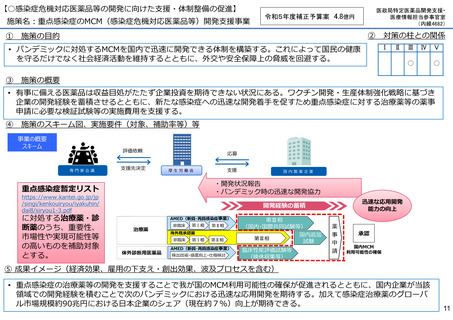
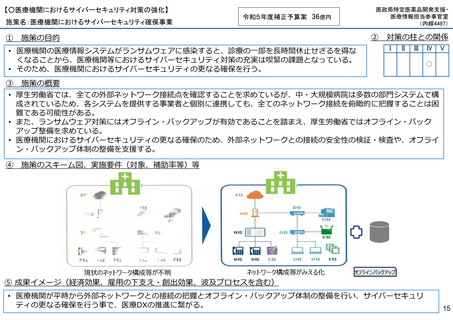
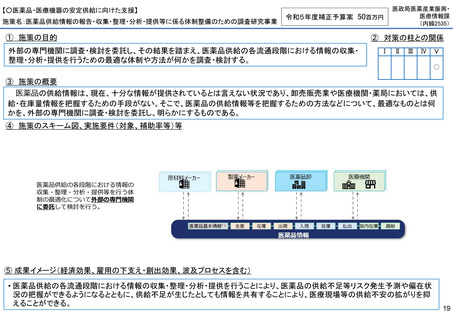
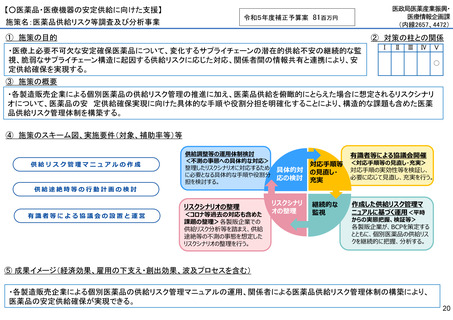
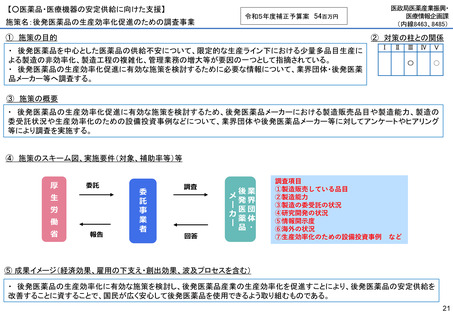
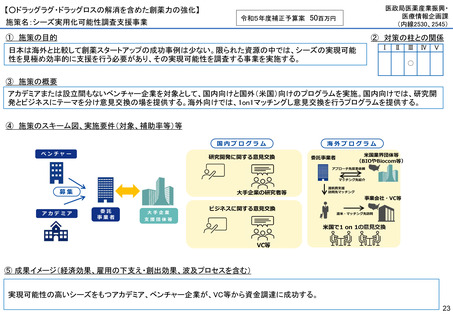
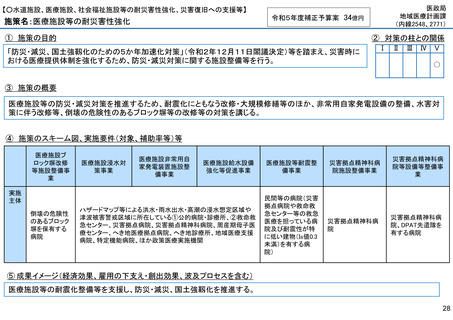
【○感染症危機対応医薬品等の開発に向けた支援・体制整備の促進】
施策名:重点感染症のMCM(感染症危機対応医薬品等)開発支援事業
①
医政局特定医薬品開発支援・
医療情報担当参事官室
(内線4682)
令和5年度補正予算案 4.8億円
②
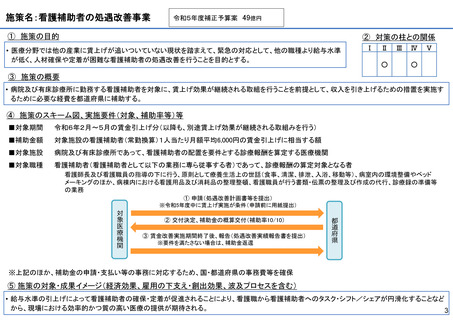
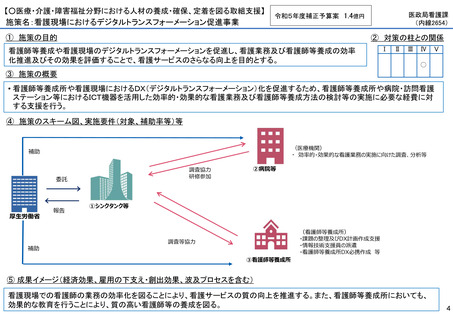
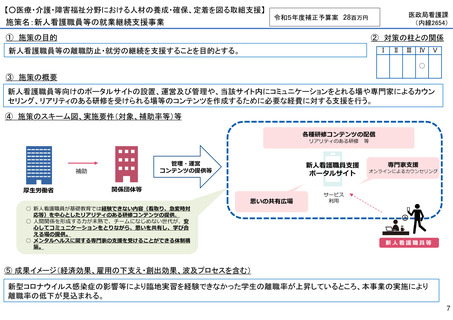
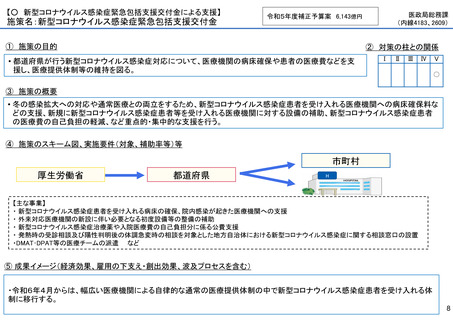
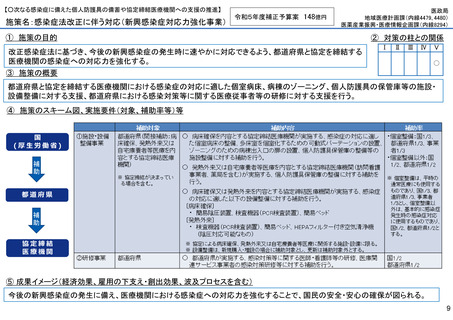
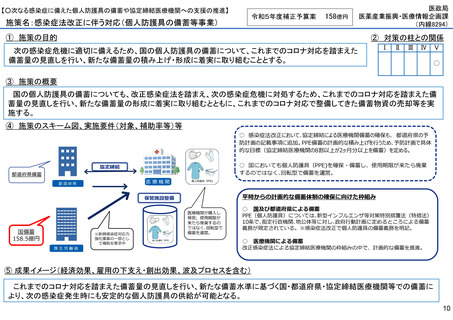
施策の目的
対策の柱との関係
Ⅰ
• パンデミックに対処するMCMを国内で迅速に開発できる体制を構築する。これによって国民の健康
を守るだけでなく社会経済活動を維持するとともに、外交や安全保障上の脅威を回避する。
③
Ⅱ
Ⅲ
Ⅳ
○
Ⅴ
○
施策の概要
• 有事に備える医薬品は収益目処がたたず企業投資を期待できない状況にある。ワクチン開発・生産体制強化戦略に基づき
企業の開発経験を蓄積させるとともに、新たな感染症への迅速な開発着手を促すため重点感染症に対する治療薬等の薬事
申請に必要な検証試験等の実施費用を支援する。
④
施策のスキーム図、実施要件(対象、補助率等)等
事業の概要
スキーム
評価依頼
専門家会議
支援先決定
応募
国内製薬企業
・開発状況報告
・パンデミック時の迅速な開発協力
重点感染症暫定リスト
https://www.kantei.go.jp/jp
/singi/kenkouiryou/iyakuhin/
dai8/siryou1-3.pdf
に対処する治療薬・診
断薬のうち、重要性、
市場性や実現可能性等
の高いものを補助対象
とする。
支援
厚生労働省
迅速な応用開発
能力の向上
開発経験の蓄積
AMED(新興・再興感染症事業)
治療薬
非臨床
第Ⅱ相
海外既承認薬
非臨床
体外診断用医薬品
第Ⅰ相
第Ⅰ相
第Ⅱ相
AMED(新興・再興感染症事業)
検出技術・感度向上・仕様検討
第Ⅲ相
(国内・国際共同試験等)
国内追加
第Ⅲ相
試験
臨床性能評価試験等
(検体収集等)
薬
事
申
請
承認
国内MCM
利用可能性の確保
⑤ 成果イメージ(経済効果、雇用の下支え・創出効果、波及プロセスを含む)
• 重点感染症の治療薬等の開発を支援することで我が国のMCM利用可能性の確保が促進されるとともに、国内企業が当該
領域での開発経験を積むことで次のパンデミックにおける迅速な応用開発を期待する。加えて感染症治療薬のグローバ
ル市場規模約90兆円における日本企業のシェア(現在約7%)向上が期待できる。
11
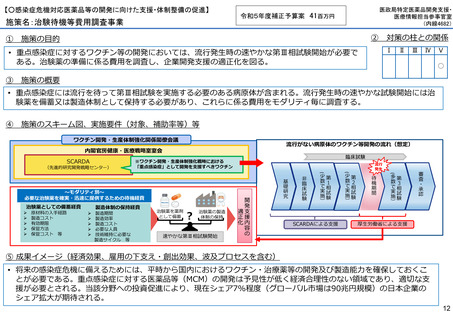
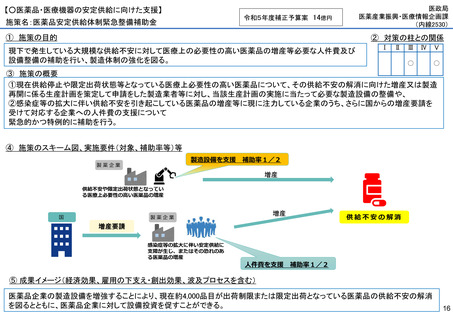
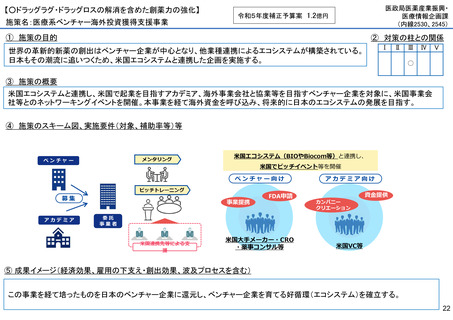
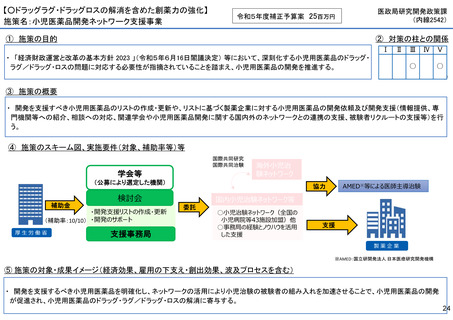
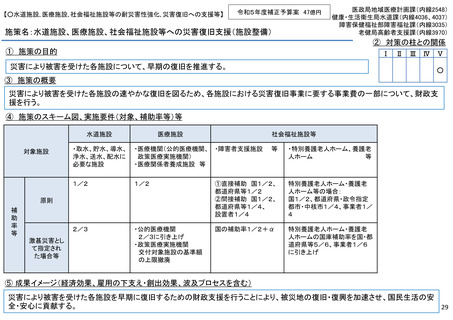
施策名:重点感染症のMCM(感染症危機対応医薬品等)開発支援事業
①
医政局特定医薬品開発支援・
医療情報担当参事官室
(内線4682)
令和5年度補正予算案 4.8億円
②
施策の目的
対策の柱との関係
Ⅰ
• パンデミックに対処するMCMを国内で迅速に開発できる体制を構築する。これによって国民の健康
を守るだけでなく社会経済活動を維持するとともに、外交や安全保障上の脅威を回避する。
③
Ⅱ
Ⅲ
Ⅳ
○
Ⅴ
○
施策の概要
• 有事に備える医薬品は収益目処がたたず企業投資を期待できない状況にある。ワクチン開発・生産体制強化戦略に基づき
企業の開発経験を蓄積させるとともに、新たな感染症への迅速な開発着手を促すため重点感染症に対する治療薬等の薬事
申請に必要な検証試験等の実施費用を支援する。
④
施策のスキーム図、実施要件(対象、補助率等)等
事業の概要
スキーム
評価依頼
専門家会議
支援先決定
応募
国内製薬企業
・開発状況報告
・パンデミック時の迅速な開発協力
重点感染症暫定リスト
https://www.kantei.go.jp/jp
/singi/kenkouiryou/iyakuhin/
dai8/siryou1-3.pdf
に対処する治療薬・診
断薬のうち、重要性、
市場性や実現可能性等
の高いものを補助対象
とする。
支援
厚生労働省
迅速な応用開発
能力の向上
開発経験の蓄積
AMED(新興・再興感染症事業)
治療薬
非臨床
第Ⅱ相
海外既承認薬
非臨床
体外診断用医薬品
第Ⅰ相
第Ⅰ相
第Ⅱ相
AMED(新興・再興感染症事業)
検出技術・感度向上・仕様検討
第Ⅲ相
(国内・国際共同試験等)
国内追加
第Ⅲ相
試験
臨床性能評価試験等
(検体収集等)
薬
事
申
請
承認
国内MCM
利用可能性の確保
⑤ 成果イメージ(経済効果、雇用の下支え・創出効果、波及プロセスを含む)
• 重点感染症の治療薬等の開発を支援することで我が国のMCM利用可能性の確保が促進されるとともに、国内企業が当該
領域での開発経験を積むことで次のパンデミックにおける迅速な応用開発を期待する。加えて感染症治療薬のグローバ
ル市場規模約90兆円における日本企業のシェア(現在約7%)向上が期待できる。
11