よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00027.html |
| 出典情報 | 患者申出療養評価会議(第44回 10/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
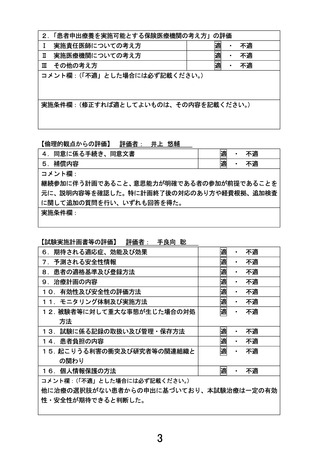
2.本技術を希望する症例が国立がん研究センター中央病院による患者申出療養「マルチプレックス
遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」へ参加できない理由につ
いてご説明下さい。
【回答】
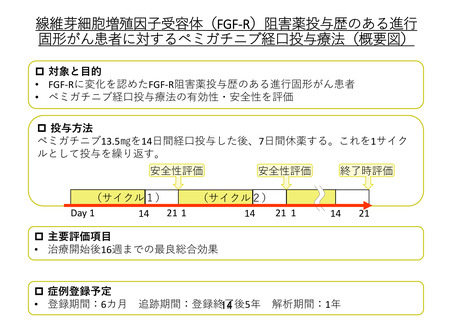
今回申出を行っている患者は FGF-R 阻害薬であるインフィグラチニブを長期間投与されております。
「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」の主要評価
項目は、治療開始後 16 週までの最良総合効果に基づく奏効割合であり、治療効果を評価する試験とな
っています。そのため、すでに FGF-R 阻害薬の投与を受けて一定の効果が得られている患者を、同じ
FGF-R を標的とするペミガチニブのコホートに登録することは適切ではないと考えております。
今回の患者は 10 年ほど前にインフィグラチニブの治験に参加し、治験終了後もインフィグラチニブ経口
投与療法の患者申出療養を希望され、継続的に当院で治療を行ってきました。長期に病勢コントロール
が得られており、今回のペミガチニブの使用にあたっても中長期的に当院が主体となって実施すること
が望ましいと考えております。なお、今回の患者申出療養で競争的な研究費等を用いる予定はなく、研
究費等に左右されず中長期にわたり継続することが可能な体制で実施する予定です。
3.進行固形がん患者に対するペミガチニブ経口投与療法の安全性の根拠について、インフィグラニ
チニブ経口投与療法と比較しつつ、ご説明ください。
【回答】
ペミガチニブのわが国の添付文書には、重大な副作用として、網膜剥離(6.1%)と高リン血症(59.5%)
が記載されています(2023 年 3 月改訂(第 4 版))。ペミガチニブ、インフィグラチニブはいずれも米国で
承認されていますが、米国の添付文書の警告と注意事項には、眼毒性、高リン酸血症及び軟部組織の
石灰化、胚-胎児毒性の 3 項目がともに記載されています。眼毒性として網膜色素上皮剥離をペミガチ
ニブでは 11%で認め、3.1%で休薬、1.3%で減量、0.2%で中止が必要となった一方で、インフィグラチニブで
は 11%で認め、3.4%で休薬あるいは減量、0.6%で中止が必要となっています。また、ドライアイをペミガチ
ニブでは 31%、インフィグラチニブでは 29%に認めています。高リン酸血症及び軟部組織の石灰化につい
ては、高リン酸血症をペミガチニブでは 93%で認め、33%でリン低下療法が必要となった一方で、インフィ
グラチニブでは 82%で認め、83%でリン吸着療法が実施されています。胚-胎児毒性については、ペミガチ
ニブ、インフィグラチニブとも、動物実験での所見とその作用機序から、妊婦に投与されると胎児に害を
及ぼす可能性があると記載されています。その他の有害事象についても挙げられている項目や頻度に
大きな違いはなく、少なくともペミガチニブがインフィグラチニブと比較して安全性が乏しいということはな
いものと考えております。
6
遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」へ参加できない理由につ
いてご説明下さい。
【回答】
今回申出を行っている患者は FGF-R 阻害薬であるインフィグラチニブを長期間投与されております。
「マルチプレックス遺伝子パネル検査による遺伝子プロファイリングに基づく分子標的治療」の主要評価
項目は、治療開始後 16 週までの最良総合効果に基づく奏効割合であり、治療効果を評価する試験とな
っています。そのため、すでに FGF-R 阻害薬の投与を受けて一定の効果が得られている患者を、同じ
FGF-R を標的とするペミガチニブのコホートに登録することは適切ではないと考えております。
今回の患者は 10 年ほど前にインフィグラチニブの治験に参加し、治験終了後もインフィグラチニブ経口
投与療法の患者申出療養を希望され、継続的に当院で治療を行ってきました。長期に病勢コントロール
が得られており、今回のペミガチニブの使用にあたっても中長期的に当院が主体となって実施すること
が望ましいと考えております。なお、今回の患者申出療養で競争的な研究費等を用いる予定はなく、研
究費等に左右されず中長期にわたり継続することが可能な体制で実施する予定です。
3.進行固形がん患者に対するペミガチニブ経口投与療法の安全性の根拠について、インフィグラニ
チニブ経口投与療法と比較しつつ、ご説明ください。
【回答】
ペミガチニブのわが国の添付文書には、重大な副作用として、網膜剥離(6.1%)と高リン血症(59.5%)
が記載されています(2023 年 3 月改訂(第 4 版))。ペミガチニブ、インフィグラチニブはいずれも米国で
承認されていますが、米国の添付文書の警告と注意事項には、眼毒性、高リン酸血症及び軟部組織の
石灰化、胚-胎児毒性の 3 項目がともに記載されています。眼毒性として網膜色素上皮剥離をペミガチ
ニブでは 11%で認め、3.1%で休薬、1.3%で減量、0.2%で中止が必要となった一方で、インフィグラチニブで
は 11%で認め、3.4%で休薬あるいは減量、0.6%で中止が必要となっています。また、ドライアイをペミガチ
ニブでは 31%、インフィグラチニブでは 29%に認めています。高リン酸血症及び軟部組織の石灰化につい
ては、高リン酸血症をペミガチニブでは 93%で認め、33%でリン低下療法が必要となった一方で、インフィ
グラチニブでは 82%で認め、83%でリン吸着療法が実施されています。胚-胎児毒性については、ペミガチ
ニブ、インフィグラチニブとも、動物実験での所見とその作用機序から、妊婦に投与されると胎児に害を
及ぼす可能性があると記載されています。その他の有害事象についても挙げられている項目や頻度に
大きな違いはなく、少なくともペミガチニブがインフィグラチニブと比較して安全性が乏しいということはな
いものと考えております。
6