よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00027.html |
| 出典情報 | 患者申出療養評価会議(第44回 10/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
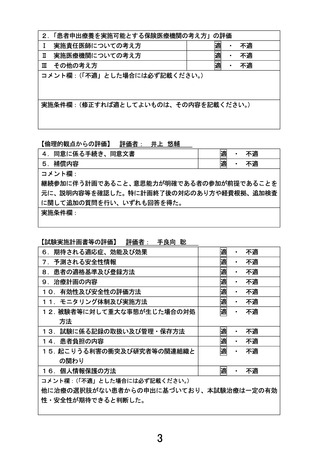
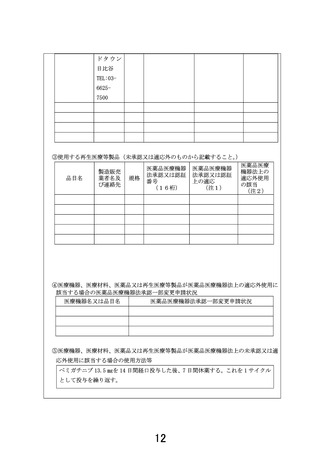
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された
適応の範囲内の使用の場合は「適応内」と記載すること。
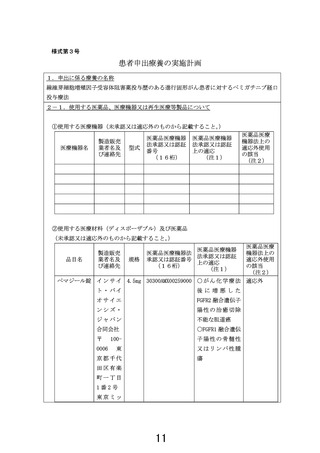
2-2.海外での承認に関する情報
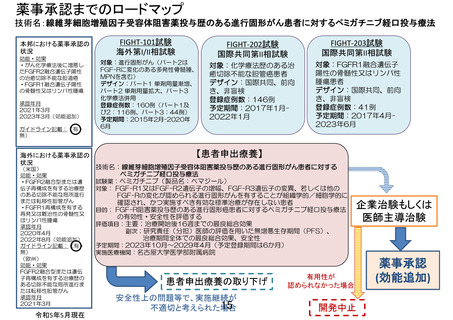
米国での薬事承認の状況
効能・効果
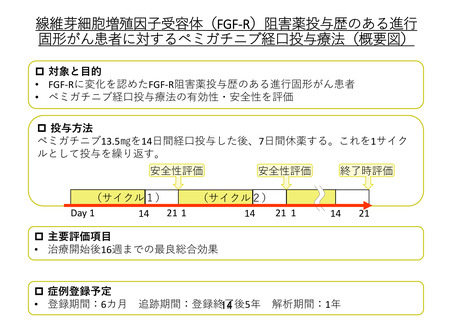
・FGFR2 融合型または遺伝子再構成を有する治療歴のある切除不能な局所進行または転移性
胆管がん
・FGFR1 再構成を有する再発又は難治性の骨髄性又はリンパ性腫瘍
承認年月 2020 年 4 月、2022 年 8 月(効能追加)
欧州での薬事承認の状況
効能・効果
FGFR2 融合型または遺伝子再構成を有する治療歴のある切除不能な局所進行または転移性胆
管がん
承認年月 2021 年 3 月
13
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された
適応の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況
効能・効果
・FGFR2 融合型または遺伝子再構成を有する治療歴のある切除不能な局所進行または転移性
胆管がん
・FGFR1 再構成を有する再発又は難治性の骨髄性又はリンパ性腫瘍
承認年月 2020 年 4 月、2022 年 8 月(効能追加)
欧州での薬事承認の状況
効能・効果
FGFR2 融合型または遺伝子再構成を有する治療歴のある切除不能な局所進行または転移性胆
管がん
承認年月 2021 年 3 月
13