よむ、つかう、まなぶ。
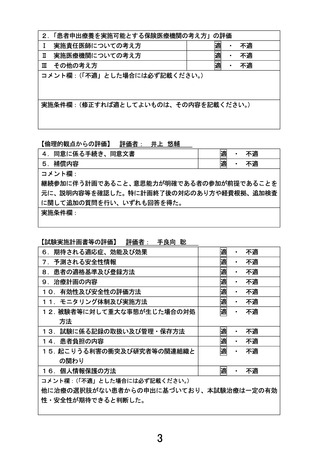
別紙1○患者申出療養に係る新規技術の科学的評価等について (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00027.html |
| 出典情報 | 患者申出療養評価会議(第44回 10/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
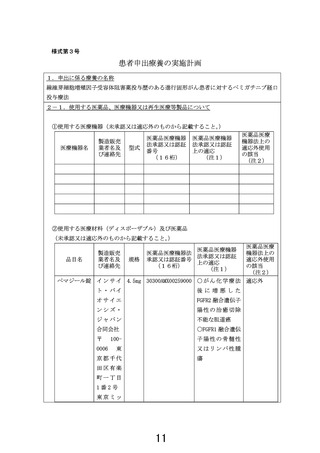
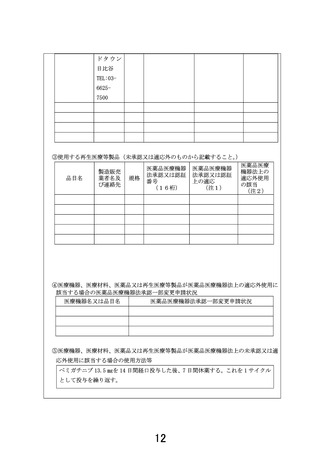
【別添5】
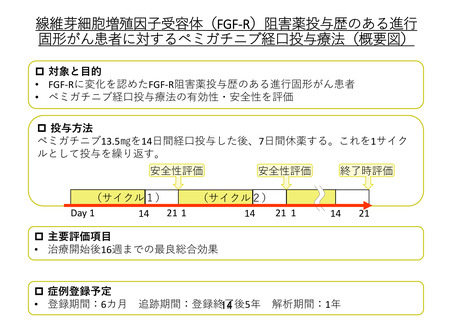
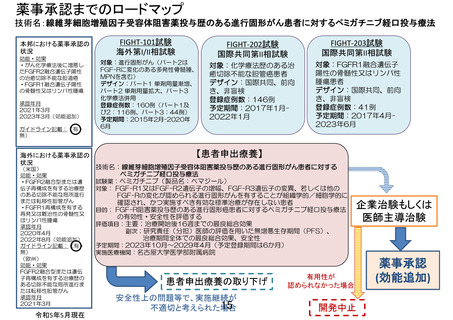
「線維芽細胞増殖因子受容体阻害薬投与歴のある進行固形がん患者に
対するペミガチニブ経口投与療法」の予定の試験期間及び症例数(意見書より抜
粋)
7-2.予定の試験期間及び症例数
予定試験期間:登録期間:6 カ月(実施承認日~2024 年 4 月 30 日)
。
追跡期間:登録終了後 5 年(登録日~2029 年 4 月 30 日)
。
解析期間:1 年(2029 年 5 月 1 日~2030 年 4 月 30 日)
。
総研究期間:6 年 6 ヶ月。
(実施承認日~2030 年 4 月 30 日)
。
予定症例数:6 ヶ月の登録期間で登録された患者を対象とする。
予定試験期間及び予定症例数の設定根拠:
本療養は、インフィグラチニブの開発中止に伴い、FGF-R 阻害薬を継続するためにペミガチ
ニブ投与を希望する患者に応える目的で患者申出療養制度に基づいて実施する研究である。
そのため、我が国で本試験の対象となる患者に対して試験が行われた経験がないことから患
者登録見込みを立てることは困難である。一方で、患者申出療養制度では最終的には対象薬
剤の薬事承認・保険適用を目指すことが制度の趣旨となっているため、漫然と試験を継続す
ることによって薬事承認・保険適用に要する期間が長くなることは避ける必要があり、一定
期間内に安全性、有効性のデータを収集し、さらなる治療開発が必要か否かを判断する必要
がある。そのため、本試験の予定登録期間は 6 ヶ月、追跡期間を登録終了後 5 年、解析期間
を 1 年とし、すべてのエンドポイントの解析を行うこととする。本試験の対象に対してペミ
ガチニブの薬事承認・保険適用がされた場合には、本試験は終了とする。ただし、患者登録
状況や当該疾患に対する治療開発状況の変化を考慮して、必要に応じて研究計画書改訂を行
い、登録期間の延長を検討することとする。なお、追跡期間終了予定日において当該試験薬
の薬事承認・保険適用が1年以内にされる見込みがある場合を除き、原則として追跡期間の
延長は行わない。
22
「線維芽細胞増殖因子受容体阻害薬投与歴のある進行固形がん患者に
対するペミガチニブ経口投与療法」の予定の試験期間及び症例数(意見書より抜
粋)
7-2.予定の試験期間及び症例数
予定試験期間:登録期間:6 カ月(実施承認日~2024 年 4 月 30 日)
。
追跡期間:登録終了後 5 年(登録日~2029 年 4 月 30 日)
。
解析期間:1 年(2029 年 5 月 1 日~2030 年 4 月 30 日)
。
総研究期間:6 年 6 ヶ月。
(実施承認日~2030 年 4 月 30 日)
。
予定症例数:6 ヶ月の登録期間で登録された患者を対象とする。
予定試験期間及び予定症例数の設定根拠:
本療養は、インフィグラチニブの開発中止に伴い、FGF-R 阻害薬を継続するためにペミガチ
ニブ投与を希望する患者に応える目的で患者申出療養制度に基づいて実施する研究である。
そのため、我が国で本試験の対象となる患者に対して試験が行われた経験がないことから患
者登録見込みを立てることは困難である。一方で、患者申出療養制度では最終的には対象薬
剤の薬事承認・保険適用を目指すことが制度の趣旨となっているため、漫然と試験を継続す
ることによって薬事承認・保険適用に要する期間が長くなることは避ける必要があり、一定
期間内に安全性、有効性のデータを収集し、さらなる治療開発が必要か否かを判断する必要
がある。そのため、本試験の予定登録期間は 6 ヶ月、追跡期間を登録終了後 5 年、解析期間
を 1 年とし、すべてのエンドポイントの解析を行うこととする。本試験の対象に対してペミ
ガチニブの薬事承認・保険適用がされた場合には、本試験は終了とする。ただし、患者登録
状況や当該疾患に対する治療開発状況の変化を考慮して、必要に応じて研究計画書改訂を行
い、登録期間の延長を検討することとする。なお、追跡期間終了予定日において当該試験薬
の薬事承認・保険適用が1年以内にされる見込みがある場合を除き、原則として追跡期間の
延長は行わない。
22