よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00027.html |
| 出典情報 | 患者申出療養評価会議(第44回 10/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別紙1
患者申出療養 実施計画等評価表
評価者
主担当:
副担当:
成川 衛
井上 悠輔、 手良向 聡
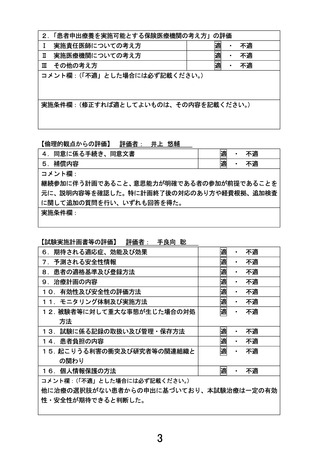
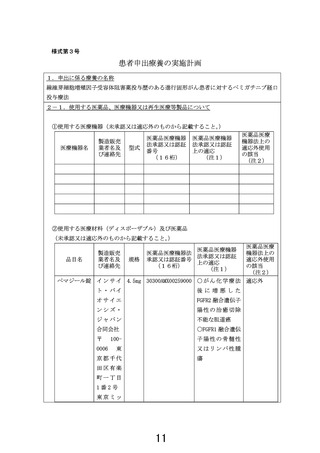
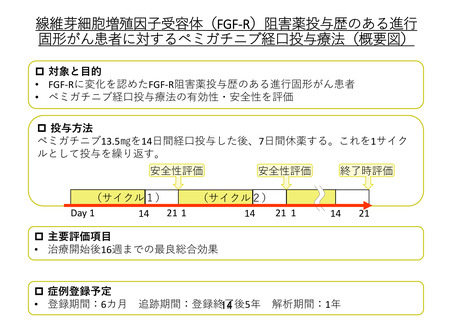
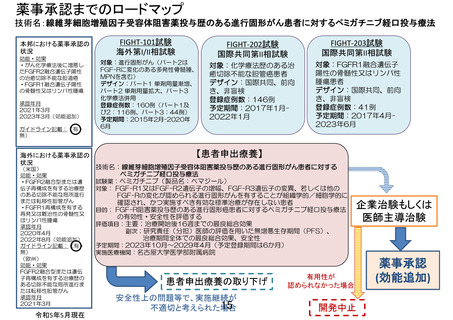
申 出 に 係 る 線維芽細胞増殖因子受容体阻害薬投与歴のある進行固形がん患者に対するペミガチ
療 養 の 名 称 ニブ経口投与療法
臨床研究中核
名古屋大学医学部附属病院
病院の名称
実施医療機関
の名称
名古屋大学医学部附属病院
(概要)
6 か月以上ペミガチニブ以外の FGF-R 阻害薬を投与され SD 以上の効果を認めた 20
歳以上の FGF-R1 又は FGF-R2 遺伝子の増幅、FGF-R3 遺伝子の変異、もしくは他の
FGF-R の変化が認められる進行固形がん患者に対し、ペミガチニブを経口投与し、
有効性と安全性を評価する。ペミガチニブは、13.5 ㎎を 14 日間経口投与した後、7
日間休薬する。これを 1 サイクルとして投与を繰り返す。
主要評価項目は、治療開始後 16 週までの最良総合効果とする。
副次的評価項目は、固形がんの治療効果判定基準(RECIST)ver. 1.1 に基づく研
究責任(分担)医師の評価を用いた無増悪生存期間(PFS)
、治療期間全体での最良
総合効果、安全性とする。
(効果)
海外第 I/II 相試験である INCB54828-101 試験では、FGF-R に変化が認められるさま
医 療 技 術 ざまな進行固形がんが登録されおり、FGF-R2 の融合のみでなく、その他の融合や変
の
概
要 異、増幅でも有効性が認められた症例が報告されている。がん腫としても胆管がん
のみでなく、頭頚部がん、胆嚢がん、子宮がんなどでも有効性が認められている。
このことから、本試験の対象となる患者においても有効性が期待される。異なる
FGF-R 阻害薬で前治療を受けた患者におけるペミガチニブの臨床活性は十分に評価
されておらず、特に前治療に反応した患者において、その薬理活性に関する貴重な
情報が得られる可能性がある。
(患者申出療養に係る費用)
本研究で用いる試験薬は供給元であるインサイト・バイオサイエンシズ・ジャパン
合同会社から無償提供を受ける。また、試験薬の投与に際して人件費や検査費用等
が必要な場合には、その費用についても全額患者の自己負担となる。
臨床研究に係る費用として、名古屋大学医学部附属病院で実施する場合には意見書
作成費用として 231,000 円、1年目の臨床研究の実施・管理費用として 539,000 円
の計 770,000 円が研究開始時までに必要となる。意見書作成費用については、意見
1
患者申出療養 実施計画等評価表
評価者
主担当:
副担当:
成川 衛
井上 悠輔、 手良向 聡
申 出 に 係 る 線維芽細胞増殖因子受容体阻害薬投与歴のある進行固形がん患者に対するペミガチ
療 養 の 名 称 ニブ経口投与療法
臨床研究中核
名古屋大学医学部附属病院
病院の名称
実施医療機関
の名称
名古屋大学医学部附属病院
(概要)
6 か月以上ペミガチニブ以外の FGF-R 阻害薬を投与され SD 以上の効果を認めた 20
歳以上の FGF-R1 又は FGF-R2 遺伝子の増幅、FGF-R3 遺伝子の変異、もしくは他の
FGF-R の変化が認められる進行固形がん患者に対し、ペミガチニブを経口投与し、
有効性と安全性を評価する。ペミガチニブは、13.5 ㎎を 14 日間経口投与した後、7
日間休薬する。これを 1 サイクルとして投与を繰り返す。
主要評価項目は、治療開始後 16 週までの最良総合効果とする。
副次的評価項目は、固形がんの治療効果判定基準(RECIST)ver. 1.1 に基づく研
究責任(分担)医師の評価を用いた無増悪生存期間(PFS)
、治療期間全体での最良
総合効果、安全性とする。
(効果)
海外第 I/II 相試験である INCB54828-101 試験では、FGF-R に変化が認められるさま
医 療 技 術 ざまな進行固形がんが登録されおり、FGF-R2 の融合のみでなく、その他の融合や変
の
概
要 異、増幅でも有効性が認められた症例が報告されている。がん腫としても胆管がん
のみでなく、頭頚部がん、胆嚢がん、子宮がんなどでも有効性が認められている。
このことから、本試験の対象となる患者においても有効性が期待される。異なる
FGF-R 阻害薬で前治療を受けた患者におけるペミガチニブの臨床活性は十分に評価
されておらず、特に前治療に反応した患者において、その薬理活性に関する貴重な
情報が得られる可能性がある。
(患者申出療養に係る費用)
本研究で用いる試験薬は供給元であるインサイト・バイオサイエンシズ・ジャパン
合同会社から無償提供を受ける。また、試験薬の投与に際して人件費や検査費用等
が必要な場合には、その費用についても全額患者の自己負担となる。
臨床研究に係る費用として、名古屋大学医学部附属病院で実施する場合には意見書
作成費用として 231,000 円、1年目の臨床研究の実施・管理費用として 539,000 円
の計 770,000 円が研究開始時までに必要となる。意見書作成費用については、意見
1