よむ、つかう、まなぶ。
資料2-8 サリドマイド登録システム(SMUD)年次報告書の公開について(報告)[1.9MB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33888.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第1回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
はじめに
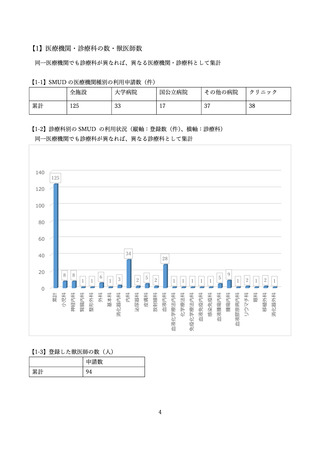
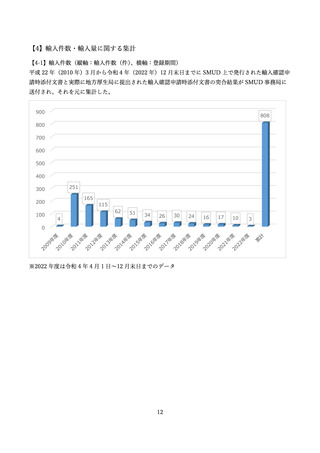
サリドマイドの使用登録・管理システムである SMUD(Safety Management system for Unapproved
Drugs)は医師等により個人輸入されるサリドマイドの使用状況等を把握するとともに、その適正使用
を確保するため、
「医師等のサリドマイドの個人輸入に係る薬監証明の発給について」
(平成 22 年 3 月
5 日付け薬食安発 0305 第 1 号・薬食監麻発 0305 第 1 号厚生労働省医薬食品局安全対策課長及び監視指
導・麻薬対策課長連名通知)により実施することとされたものです。
SMUD 運用開始当時、厚生労働省からの委託の下、特定非営利活動法人 日本医薬品安全性研究ユニ
ット(以下「NPO 日本医薬品安全性研究ユニット」という。
)が SMUD 事務局となり運営されていま
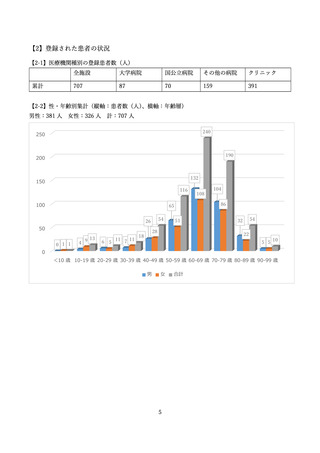
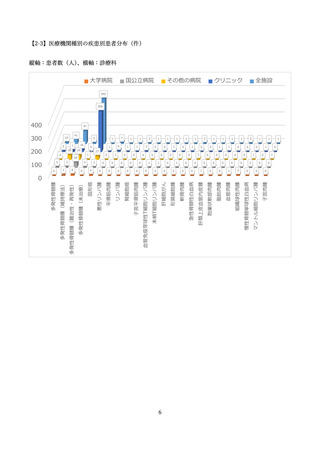
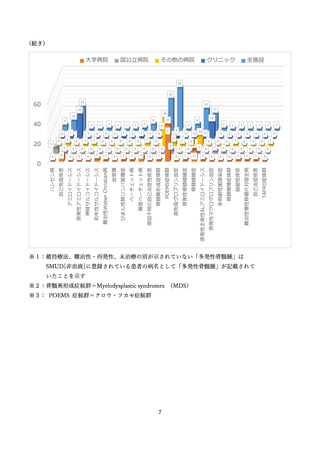
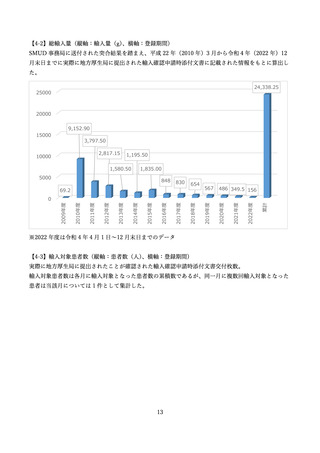
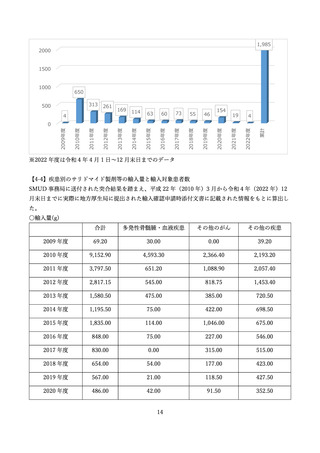
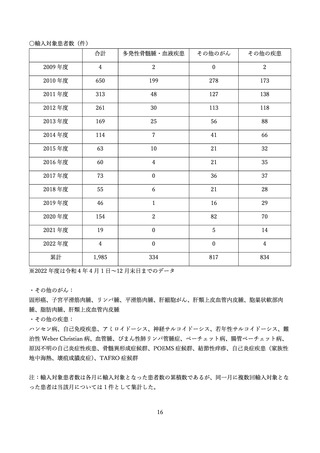
した。また、NPO 日本医薬品安全性研究ユニットにより、SMUD に登録された医療機関、獣医師数、
患者、患者のうち特に妊娠可能な女性患者の数等が定期的に一般に公開されてきました。
運用開始から 10 年が経過し、不具合等が増加していたため、SMUD を改修するとともに、令和 3 年
4 月 1 日より、サリドマイドに加え、レナリドミド及びポマリドミドについてもサリドマイドと同様の
登録・管理を行うことなり、併せて、SMUD 事務局を厚生労働省医薬・生活衛生局医薬安全対策課が務め
ることとなりました。
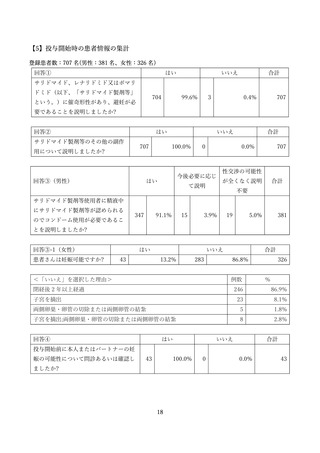
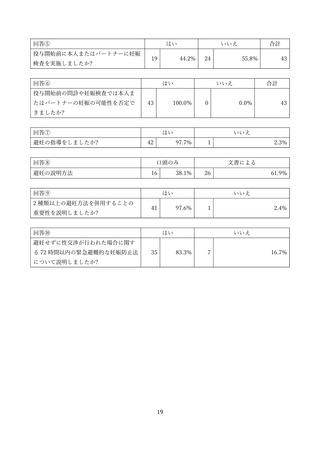
SMUD を利用する利用者(通常医師)は、患者新規登録時に SMUD 上でサリドマイド製剤等の安全
な使用のために必要な注意事項の説明や避妊に関する指導・妊娠検査の実施等に関する質問に回答する
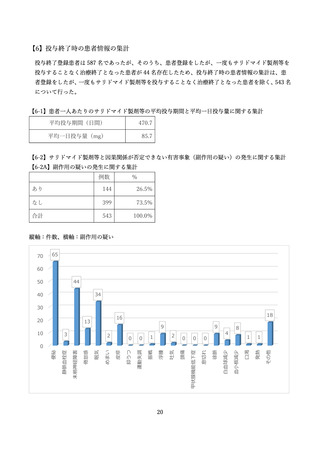
ことが求められます。また、治療終了登録時には、SMUD 上で治療中のサリドマイド製剤等の安全管理
の実施状況や治療中に発生した副作用等に関する質問に回答することが求められます。これらの回答の
集計についても SMUD を利用する医師等にサリドマイド製剤等の管理・治療上の参考にしていただく
とともに、サリドマイド製剤等の安全管理の実施状況を広く知っていただくため、引き続き一般に公開
することとしています。本報告書では患者新規登録時と治療終了時アンケートの集計結果を示していま
す。
さらに、平成 28 年度から、個人輸入されるサリドマイドの安全性の確認に資することを目的に、サ
リドマイドによる胎児曝露を防止するためのモニタリングが実施されており、NPO 日本医薬品安全性
研究ユニットによる公表情報との一貫性に留意し、
「妊娠可能な女性患者のモニタリング」として概要
を示しています(本報告書の【7】参照)
。
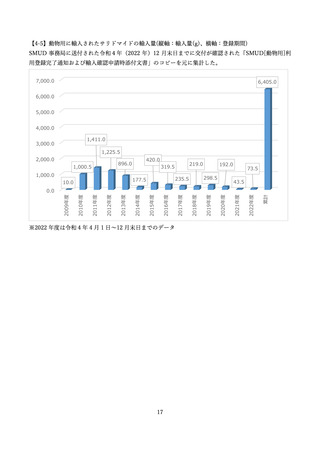
本報告書は、SMUD 運用開始から令和4年 12 月までの SMUD に関連する集計データを報告するも
のです。なお、レナリドミド及びポマリドミドについては、令和4年 12 月時点においては、登録はあ
りませんでした。
2
サリドマイドの使用登録・管理システムである SMUD(Safety Management system for Unapproved
Drugs)は医師等により個人輸入されるサリドマイドの使用状況等を把握するとともに、その適正使用
を確保するため、
「医師等のサリドマイドの個人輸入に係る薬監証明の発給について」
(平成 22 年 3 月
5 日付け薬食安発 0305 第 1 号・薬食監麻発 0305 第 1 号厚生労働省医薬食品局安全対策課長及び監視指
導・麻薬対策課長連名通知)により実施することとされたものです。
SMUD 運用開始当時、厚生労働省からの委託の下、特定非営利活動法人 日本医薬品安全性研究ユニ
ット(以下「NPO 日本医薬品安全性研究ユニット」という。
)が SMUD 事務局となり運営されていま
した。また、NPO 日本医薬品安全性研究ユニットにより、SMUD に登録された医療機関、獣医師数、
患者、患者のうち特に妊娠可能な女性患者の数等が定期的に一般に公開されてきました。
運用開始から 10 年が経過し、不具合等が増加していたため、SMUD を改修するとともに、令和 3 年
4 月 1 日より、サリドマイドに加え、レナリドミド及びポマリドミドについてもサリドマイドと同様の
登録・管理を行うことなり、併せて、SMUD 事務局を厚生労働省医薬・生活衛生局医薬安全対策課が務め
ることとなりました。
SMUD を利用する利用者(通常医師)は、患者新規登録時に SMUD 上でサリドマイド製剤等の安全
な使用のために必要な注意事項の説明や避妊に関する指導・妊娠検査の実施等に関する質問に回答する
ことが求められます。また、治療終了登録時には、SMUD 上で治療中のサリドマイド製剤等の安全管理
の実施状況や治療中に発生した副作用等に関する質問に回答することが求められます。これらの回答の
集計についても SMUD を利用する医師等にサリドマイド製剤等の管理・治療上の参考にしていただく
とともに、サリドマイド製剤等の安全管理の実施状況を広く知っていただくため、引き続き一般に公開
することとしています。本報告書では患者新規登録時と治療終了時アンケートの集計結果を示していま
す。
さらに、平成 28 年度から、個人輸入されるサリドマイドの安全性の確認に資することを目的に、サ
リドマイドによる胎児曝露を防止するためのモニタリングが実施されており、NPO 日本医薬品安全性
研究ユニットによる公表情報との一貫性に留意し、
「妊娠可能な女性患者のモニタリング」として概要
を示しています(本報告書の【7】参照)
。
本報告書は、SMUD 運用開始から令和4年 12 月までの SMUD に関連する集計データを報告するも
のです。なお、レナリドミド及びポマリドミドについては、令和4年 12 月時点においては、登録はあ
りませんでした。
2