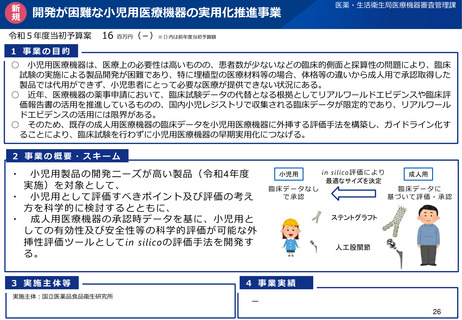
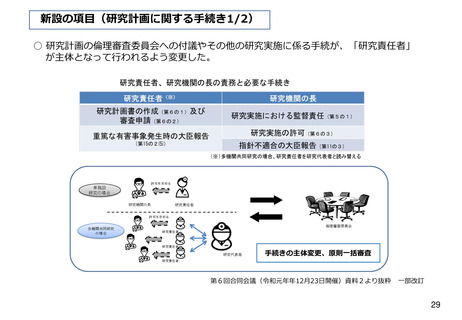
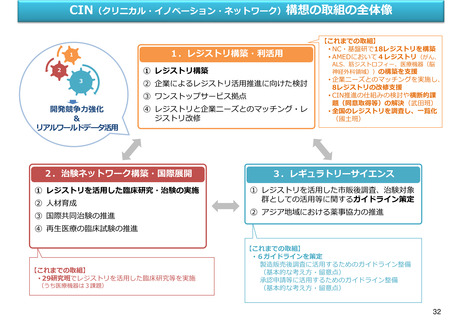
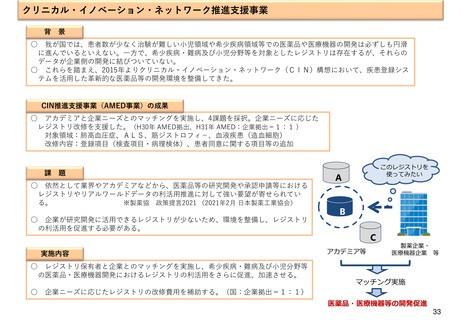
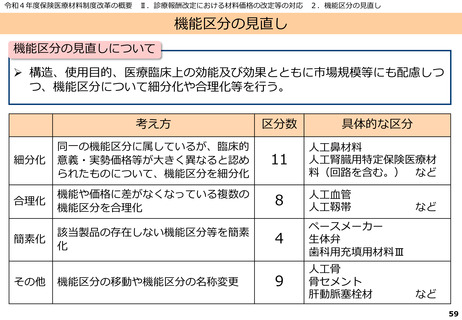
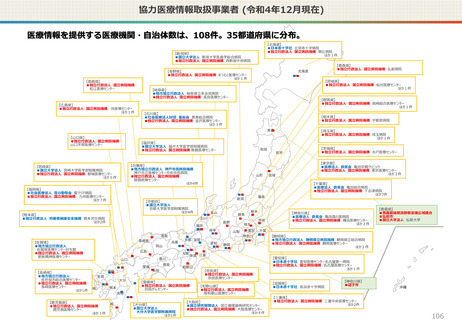
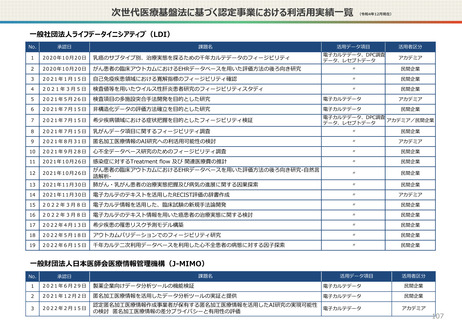
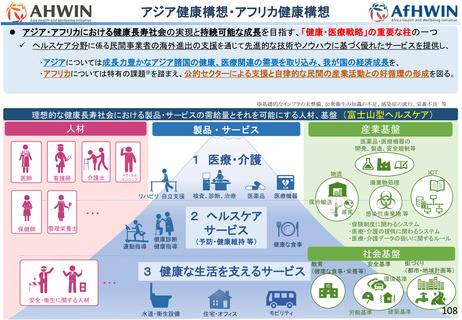
資料2-1 医療機器基本計画に関する各省における取り組みの状況について (60 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi/other-isei_256018.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第3回 3/28)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
作成 。
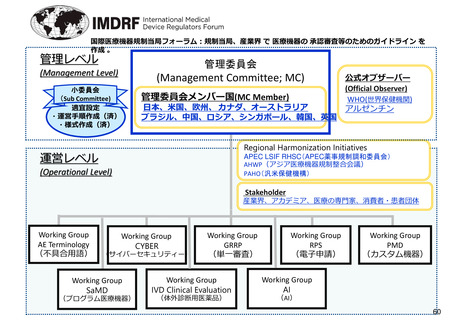
管理レベル
管理委員会
(Management Level)
(Management Committee; MC)
小委員会
(Sub Committee)
適宜設定
・運営手順作成(済)
・様式作成(済)
管理委員会メンバー国(MC Member)
日本、米国、欧州、 カナダ、オーストラリア
ブラジル、中国、ロシア、シンガポール、韓国、英国
公式オブザーバー
(Official Observer)
WHO(世界保健機関)
アルゼンチン
Regional Harmonization Initiatives
運営レベル
APEC LSIF RHSC(APEC薬事規制調和委員会)
AHWP(アジア医療機器規制整合会議)
PAHO(汎米保健機構)
(Operational Level)
Stakeholder
産業界、アカデミア、医療の専門家、消費者・患者団体
Working Group
AE Terminology
(不具合用語)
Working Group
CYBER
(サイバーセキュリティー)
Working Group
SaMD
(プログラム医療機器)
Working Group
GRRP
(単一審査)
Working Group
IVD Clinical Evaluation
(体外診断用医薬品)
Working Group
RPS
(電子申請)
Working Group
PMD
(カスタム機器)
Working Group
AI
(AI)
60