よむ、つかう、まなぶ。
03【資料1】新型コロナワクチンの接種について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28621.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第39回 10/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.本日の論点:【1】新型コロナワクチンの追加接種に係る接種間隔について
(1)接種間隔について
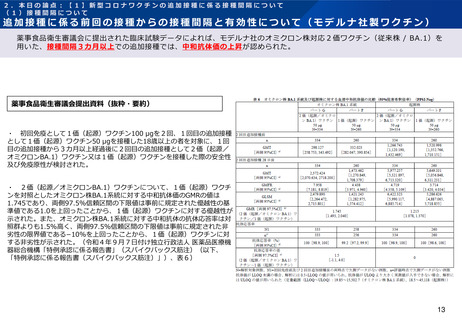
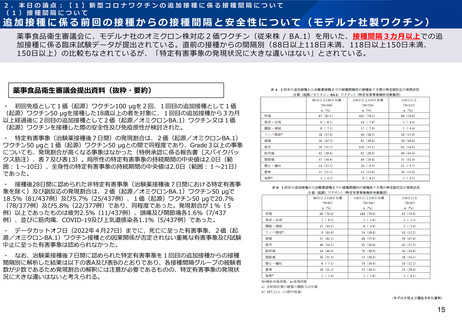
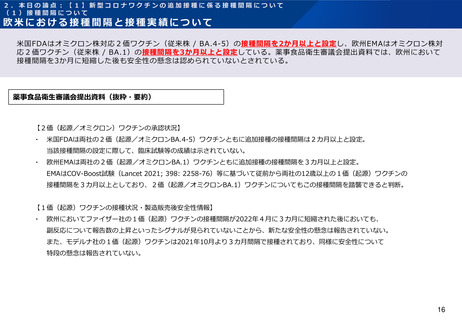
追加接種に係る前回の接種からの接種間隔と安全性について(モデルナ社製ワクチン)
薬事食品衛生審議会に、モデルナ社のオミクロン株対応2価ワクチン(従来株 / BA.1)を用いた、接種間隔3カ月以上での追
加接種に係る臨床試験データが提出されている。直前の接種からの間隔別(88日以上118日未満、118日以上150日未満、
150日以上)の比較もなされているが、「特定有害事象の発現状況に大きな違いはない」とされている。
薬事食品衛生審議会提出資料(抜粋・要約)
・ 初回免疫として1価(起源)ワクチン100 μgを2回、1回目の追加接種として1価
(起源)ワクチン50 μgを接種した18歳以上の者を対象に、1回目の追加接種から3カ月
以上経過後に2回目の追加接種として2価(起源/オミクロンBA.1)ワクチン又は1価
(起源)ワクチンを接種した際の安全性及び免疫原性が検討された。
・ 特定有害事象(治験薬接種後7日間)の発現割合は、2価(起源/オミクロンBA.1)
ワクチン50 μgと1価(起源)ワクチン50 μgとの間で同程度であり、Grade3以上の事象
についても、発現割合が高くなる事象はなかった(特例承認に係る報告書(スパイクバッ
クス筋注)、表7及び表13)。局所性の特定有害事象の持続期間の中央値は2.0日(範
囲:1~10日)、全身性の特定有害事象の持続期間の中央値は2.0日(範囲:1~21日)
であった。
・ 接種後28日間に認められた非特定有害事象(治験薬接種後7日間における特定有害事
象を除く)及び副反応の発現割合は、2価(起源/オミクロンBA.1)ワクチン50 μgで
18.5%(81/437例)及び5.7%(25/437例)、1価(起源)ワクチン50 μgで20.7%
(78/377例)及び5.8%(22/377例)であり、同程度であった。発現割合が1%(5
例)以上であったものは疲労2.5%(11/437例)、頭痛及び関節痛各1.6%(7/437
例)、並びに筋肉痛、COVID-19及び上気道感染各1.1%(5/437例)であった。
・ データカットオフ日(2022年4月27日)までに、死亡に至った有害事象、2価(起
源/オミクロンBA.1)ワクチン接種との因果関係が否定されない重篤な有害事象及び試験
中止に至った有害事象は認められなかった。
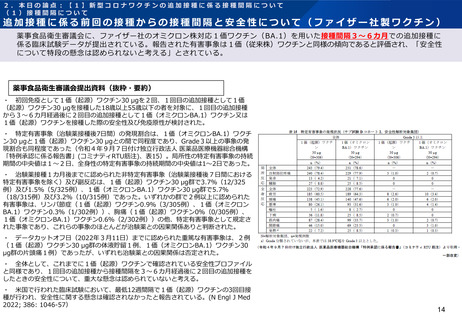
・ なお、治験薬接種後7日間に認められた特定有害事象を1回目の追加接種からの接種
間隔別に解析した結果は以下の表A及び表Bのとおりであり、各接種間隔グループの被験者
数が少数であるため発現割合の解釈には注意が必要であるものの、特定有害事象の発現状
況に大きな違いはないと考えられる。
15
(1)接種間隔について
追加接種に係る前回の接種からの接種間隔と安全性について(モデルナ社製ワクチン)
薬事食品衛生審議会に、モデルナ社のオミクロン株対応2価ワクチン(従来株 / BA.1)を用いた、接種間隔3カ月以上での追
加接種に係る臨床試験データが提出されている。直前の接種からの間隔別(88日以上118日未満、118日以上150日未満、
150日以上)の比較もなされているが、「特定有害事象の発現状況に大きな違いはない」とされている。
薬事食品衛生審議会提出資料(抜粋・要約)
・ 初回免疫として1価(起源)ワクチン100 μgを2回、1回目の追加接種として1価
(起源)ワクチン50 μgを接種した18歳以上の者を対象に、1回目の追加接種から3カ月
以上経過後に2回目の追加接種として2価(起源/オミクロンBA.1)ワクチン又は1価
(起源)ワクチンを接種した際の安全性及び免疫原性が検討された。
・ 特定有害事象(治験薬接種後7日間)の発現割合は、2価(起源/オミクロンBA.1)
ワクチン50 μgと1価(起源)ワクチン50 μgとの間で同程度であり、Grade3以上の事象
についても、発現割合が高くなる事象はなかった(特例承認に係る報告書(スパイクバッ
クス筋注)、表7及び表13)。局所性の特定有害事象の持続期間の中央値は2.0日(範
囲:1~10日)、全身性の特定有害事象の持続期間の中央値は2.0日(範囲:1~21日)
であった。
・ 接種後28日間に認められた非特定有害事象(治験薬接種後7日間における特定有害事
象を除く)及び副反応の発現割合は、2価(起源/オミクロンBA.1)ワクチン50 μgで
18.5%(81/437例)及び5.7%(25/437例)、1価(起源)ワクチン50 μgで20.7%
(78/377例)及び5.8%(22/377例)であり、同程度であった。発現割合が1%(5
例)以上であったものは疲労2.5%(11/437例)、頭痛及び関節痛各1.6%(7/437
例)、並びに筋肉痛、COVID-19及び上気道感染各1.1%(5/437例)であった。
・ データカットオフ日(2022年4月27日)までに、死亡に至った有害事象、2価(起
源/オミクロンBA.1)ワクチン接種との因果関係が否定されない重篤な有害事象及び試験
中止に至った有害事象は認められなかった。
・ なお、治験薬接種後7日間に認められた特定有害事象を1回目の追加接種からの接種
間隔別に解析した結果は以下の表A及び表Bのとおりであり、各接種間隔グループの被験者
数が少数であるため発現割合の解釈には注意が必要であるものの、特定有害事象の発現状
況に大きな違いはないと考えられる。
15