よむ、つかう、まなぶ。
03【資料1】新型コロナワクチンの接種について (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28621.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第39回 10/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.本日の論点:【1】新型コロナワクチンの追加接種に係る接種間隔について
(1)接種間隔について
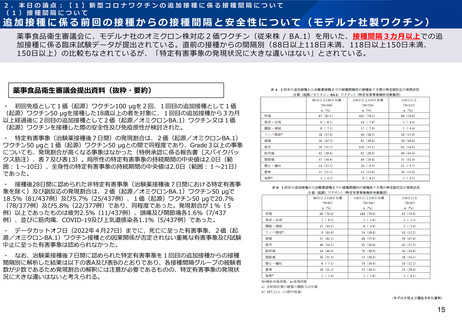
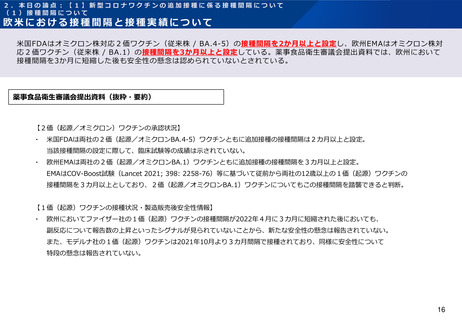
追加接種に係る前回の接種からの接種間隔と安全性について(ファイザー社製ワクチン)
薬事食品衛生審議会に、ファイザー社のオミクロン株対応1価ワクチン(BA.1)を用いた接種間隔3~6カ月での追加接種に
係る臨床試験データが提出されている。報告された有害事象は1価(従来株)ワクチンと同様の傾向であると評価され、「安全性
について特段の懸念は認められないと考える」とされている。
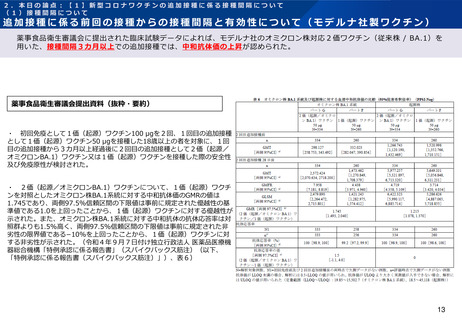
薬事食品衛生審議会提出資料(抜粋・要約)
・ 初回免疫として1価(起源)ワクチン30 μgを2回、1回目の追加接種として1価
(起源)ワクチン30 μgを接種した18歳以上55歳以下の者を対象に、1回目の追加接種
から3~6カ月経過後に2回目の追加接種として1価(オミクロンBA.1)ワクチン又は
1価(起源)ワクチンを接種した際の安全性及び免疫原性が検討された。
・ 特定有害事象(治験薬接種後7日間)の発現割合は、1価(オミクロンBA.1)ワクチ
ン30 μgと1価(起源)ワクチン30 μgとの間で同程度であり、Grade3以上の事象の発
現割合も同程度であった(令和4年9月7日付け独立行政法人 医薬品医療機器総合機構
「特例承認に係る報告書」(コミナティRTU筋注)、表15)。局所性の特定有害事象の持続
期間の中央値は1~2日、全身性の特定有害事象の持続期間の中央値は1~2日であった。
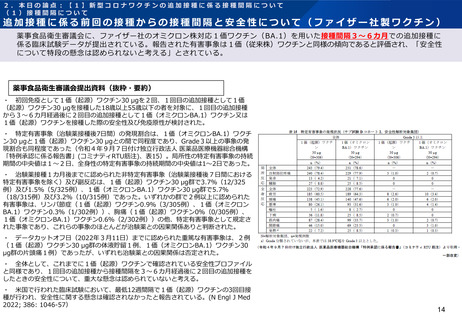
・ 治験薬接種1カ月後までに認められた非特定有害事象(治験薬接種後7日間における
特定有害事象を除く)及び副反応は、1価(起源)ワクチン30 μg群で3.7%(12/325
例)及び1.5%(5/325例)、1価(オミクロンBA.1)ワクチン30 μg群で5.7%
(18/315例)及び3.2%(10/315例)であった。いずれかの群で2例以上に認められた
有害事象は、リンパ節症(1価(起源)ワクチン0.9%(3/305例)、1価(オミクロン
BA.1)ワクチン0.3%(1/302例))、胸痛(1価(起源)ワクチン0%(0/305例)、
1価(オミクロンBA.1)ワクチン0.6%(2/302例))の他、特定有害事象として規定さ
れた事象であり、これらの事象のほとんどが治験薬との因果関係ありと判断された。
・ データカットオフ日(2022年3月11日)までに認められた重篤な有害事象は、2例
(1価(起源)ワクチン30 μg群の体液貯留1例、1価(オミクロンBA.1)ワクチン30
μg群の片頭痛1例)であったが、いずれも治験薬との因果関係は否定された。
・ 全体として、これまでに1価(起源)ワクチンで確認されている安全性プロファイル
と同様であり、1回目の追加接種から接種間隔を3~6カ月経過後に2回目の追加接種を
したときの安全性について、重大な懸念は認められていないと考える。
・ 米国で行われた臨床試験において、最低12週間隔で1価(起源)ワクチンの3回目接
種が行われ、安全性に関する懸念は確認されなかったと報告されている。(N Engl J Med
2022; 386: 1046-57)
14
(1)接種間隔について
追加接種に係る前回の接種からの接種間隔と安全性について(ファイザー社製ワクチン)
薬事食品衛生審議会に、ファイザー社のオミクロン株対応1価ワクチン(BA.1)を用いた接種間隔3~6カ月での追加接種に
係る臨床試験データが提出されている。報告された有害事象は1価(従来株)ワクチンと同様の傾向であると評価され、「安全性
について特段の懸念は認められないと考える」とされている。
薬事食品衛生審議会提出資料(抜粋・要約)
・ 初回免疫として1価(起源)ワクチン30 μgを2回、1回目の追加接種として1価
(起源)ワクチン30 μgを接種した18歳以上55歳以下の者を対象に、1回目の追加接種
から3~6カ月経過後に2回目の追加接種として1価(オミクロンBA.1)ワクチン又は
1価(起源)ワクチンを接種した際の安全性及び免疫原性が検討された。
・ 特定有害事象(治験薬接種後7日間)の発現割合は、1価(オミクロンBA.1)ワクチ
ン30 μgと1価(起源)ワクチン30 μgとの間で同程度であり、Grade3以上の事象の発
現割合も同程度であった(令和4年9月7日付け独立行政法人 医薬品医療機器総合機構
「特例承認に係る報告書」(コミナティRTU筋注)、表15)。局所性の特定有害事象の持続
期間の中央値は1~2日、全身性の特定有害事象の持続期間の中央値は1~2日であった。
・ 治験薬接種1カ月後までに認められた非特定有害事象(治験薬接種後7日間における
特定有害事象を除く)及び副反応は、1価(起源)ワクチン30 μg群で3.7%(12/325
例)及び1.5%(5/325例)、1価(オミクロンBA.1)ワクチン30 μg群で5.7%
(18/315例)及び3.2%(10/315例)であった。いずれかの群で2例以上に認められた
有害事象は、リンパ節症(1価(起源)ワクチン0.9%(3/305例)、1価(オミクロン
BA.1)ワクチン0.3%(1/302例))、胸痛(1価(起源)ワクチン0%(0/305例)、
1価(オミクロンBA.1)ワクチン0.6%(2/302例))の他、特定有害事象として規定さ
れた事象であり、これらの事象のほとんどが治験薬との因果関係ありと判断された。
・ データカットオフ日(2022年3月11日)までに認められた重篤な有害事象は、2例
(1価(起源)ワクチン30 μg群の体液貯留1例、1価(オミクロンBA.1)ワクチン30
μg群の片頭痛1例)であったが、いずれも治験薬との因果関係は否定された。
・ 全体として、これまでに1価(起源)ワクチンで確認されている安全性プロファイル
と同様であり、1回目の追加接種から接種間隔を3~6カ月経過後に2回目の追加接種を
したときの安全性について、重大な懸念は認められていないと考える。
・ 米国で行われた臨床試験において、最低12週間隔で1価(起源)ワクチンの3回目接
種が行われ、安全性に関する懸念は確認されなかったと報告されている。(N Engl J Med
2022; 386: 1046-57)
14