よむ、つかう、まなぶ。
資料4-7 レトロゾール (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00022.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第50回 1/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
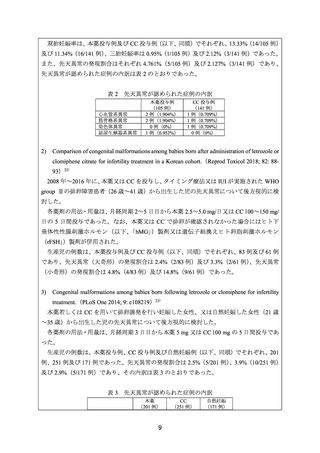
不明不妊患者における排卵誘発に本薬が投与され、妊娠及び出産が可能であったことが確
認できる(6.(2)参照)
。
以上より、検討会議は、日本人の原因不明不妊の患者における排卵誘発に対する本薬の
有効性は医学薬学上公知であると判断する。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
原因不明不妊の患者を対象とした海外臨床試験において、本薬(2.5~7.5 mg/日)の投与
により、既承認効能・効果で副作用として注意喚起されている、ほてり、頭痛、疲労等が認
められたが、その発現割合はいずれも CC やゴナドトロピンと同程度であった
12)
。また、
生殖医療に係る医薬品の国内使用実態調査において、本薬との因果関係が否定できない有
害事象として認められた有害事象は下痢及び体調不良のみであり、いずれも重症度は軽度
であり、軽快している。
本薬の既承認効能・効果では、国内承認申請時に提出された非臨床生殖発生毒性試験に
おいて、胎児死亡及び催奇形性、並びに分娩障害が確認されていること、及び本薬により
排卵した後に妊娠した不妊症(PCOS 及び原因不明不妊)患者から出生した児に先天異常が
認められた報告 25)等を踏まえ、妊婦又は妊娠している可能性のある婦人への本薬の投与は
禁忌とされている。
原因不明不妊の患者への本薬投与時の先天異常の発現について調査した結果、関連する
情報は、以下のとおりであった。海外臨床試験において、本薬(2.5~5 mg/日)を用いたと
きの児の先天異常の発現割合は、本邦において原因不明不妊に対して使用実態のある 4)CC
やゴナドトロピンと同程度であった 12)。また、本薬の催奇形性を評価した観察研究におい
て、児の先天異常の発現割合は、本薬投与例、CC 投与例、自然妊娠例で差異はなく、児に
先天異常が認められた症例における発現事象の内訳も本薬使用時に特徴的な傾向は認めら
れなかった(5.(1)参照)。メタ・アナリシスの結果においても、CC 等の排卵誘発薬投与
例、及び自然妊娠例と比較して、本薬投与例の児の先天異常の発現割合は同程度であった
(5.(2)参照)
。
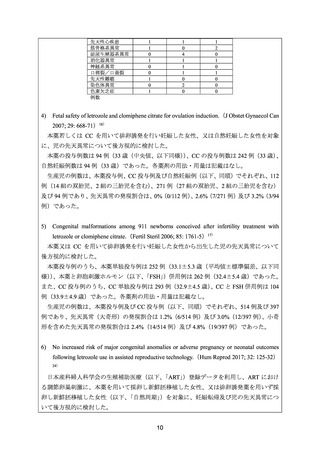
さらに、開発要請を受けた企業が 2006 年 1 月から 2021 年 12 月 15 日までに収集したフ
ェマーラ錠 2.5 mg の国内副作用報告のうち、フェマーラ錠 2.5 mg の使用理由が「排卵誘
発」、「妊娠時の胎児の曝露」又は「不妊症」であった 10 例 17 件の副作用の内訳は以下の
とおりであった。児に認められた事象を含め報告された事象について、詳細不明であり関
連性が判断できない事象や他の要因が考えられる事象を除けば、既に添付文書で注意喚起
がなされており、追加の安全対策の必要はない旨、開発要請を受けた企業は説明している。
MedDRA 器官別大分類の「先天性、家族性及び遺伝性障害」に該当する副作用として、
四肢奇形、合指症、発育性股関節形成不全、先天性膝関節脱臼、弯足、腓骨欠損、21 ト
リソミー及び副耳各 1 件が報告された。
MedDRA 器官別大分類の「妊娠、産褥及び周産期の状態」に該当する副作用として、
16
認できる(6.(2)参照)
。
以上より、検討会議は、日本人の原因不明不妊の患者における排卵誘発に対する本薬の
有効性は医学薬学上公知であると判断する。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
原因不明不妊の患者を対象とした海外臨床試験において、本薬(2.5~7.5 mg/日)の投与
により、既承認効能・効果で副作用として注意喚起されている、ほてり、頭痛、疲労等が認
められたが、その発現割合はいずれも CC やゴナドトロピンと同程度であった
12)
。また、
生殖医療に係る医薬品の国内使用実態調査において、本薬との因果関係が否定できない有
害事象として認められた有害事象は下痢及び体調不良のみであり、いずれも重症度は軽度
であり、軽快している。
本薬の既承認効能・効果では、国内承認申請時に提出された非臨床生殖発生毒性試験に
おいて、胎児死亡及び催奇形性、並びに分娩障害が確認されていること、及び本薬により
排卵した後に妊娠した不妊症(PCOS 及び原因不明不妊)患者から出生した児に先天異常が
認められた報告 25)等を踏まえ、妊婦又は妊娠している可能性のある婦人への本薬の投与は
禁忌とされている。
原因不明不妊の患者への本薬投与時の先天異常の発現について調査した結果、関連する
情報は、以下のとおりであった。海外臨床試験において、本薬(2.5~5 mg/日)を用いたと
きの児の先天異常の発現割合は、本邦において原因不明不妊に対して使用実態のある 4)CC
やゴナドトロピンと同程度であった 12)。また、本薬の催奇形性を評価した観察研究におい
て、児の先天異常の発現割合は、本薬投与例、CC 投与例、自然妊娠例で差異はなく、児に
先天異常が認められた症例における発現事象の内訳も本薬使用時に特徴的な傾向は認めら
れなかった(5.(1)参照)。メタ・アナリシスの結果においても、CC 等の排卵誘発薬投与
例、及び自然妊娠例と比較して、本薬投与例の児の先天異常の発現割合は同程度であった
(5.(2)参照)
。
さらに、開発要請を受けた企業が 2006 年 1 月から 2021 年 12 月 15 日までに収集したフ
ェマーラ錠 2.5 mg の国内副作用報告のうち、フェマーラ錠 2.5 mg の使用理由が「排卵誘
発」、「妊娠時の胎児の曝露」又は「不妊症」であった 10 例 17 件の副作用の内訳は以下の
とおりであった。児に認められた事象を含め報告された事象について、詳細不明であり関
連性が判断できない事象や他の要因が考えられる事象を除けば、既に添付文書で注意喚起
がなされており、追加の安全対策の必要はない旨、開発要請を受けた企業は説明している。
MedDRA 器官別大分類の「先天性、家族性及び遺伝性障害」に該当する副作用として、
四肢奇形、合指症、発育性股関節形成不全、先天性膝関節脱臼、弯足、腓骨欠損、21 ト
リソミー及び副耳各 1 件が報告された。
MedDRA 器官別大分類の「妊娠、産褥及び周産期の状態」に該当する副作用として、
16