よむ、つかう、まなぶ。
資料4-5 メトホルミン塩酸塩 (10 ページ)
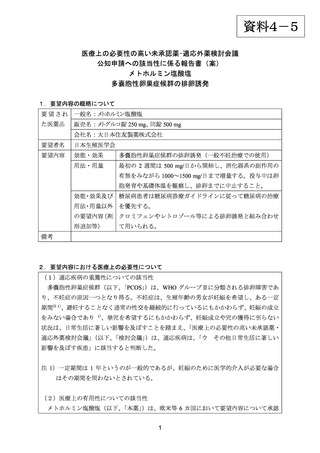
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00022.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第50回 1/26)《厚生労働省》 |
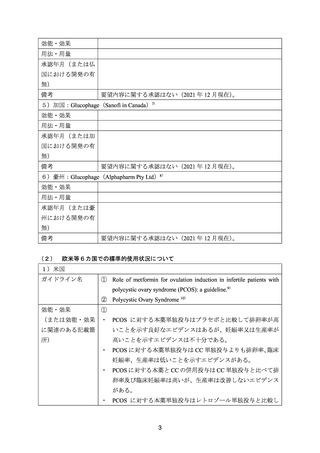
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
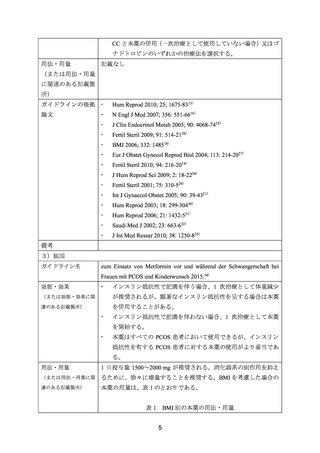
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
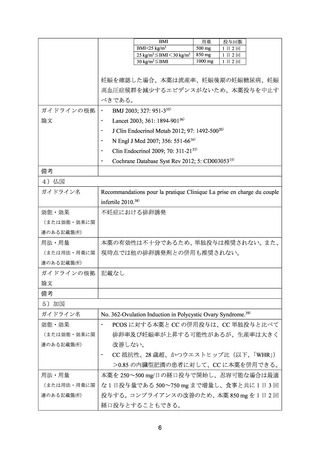
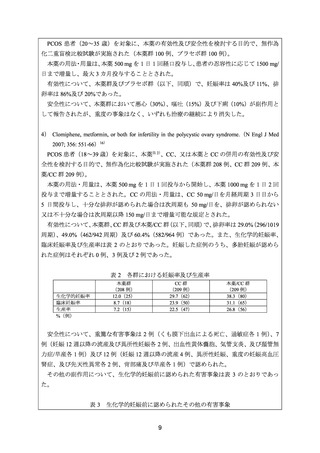
下痢
吐き気
腹部痛/腹部不快感
頭痛
嘔吐
腹部膨満感
疲労
鼓腸
気分変化/変動
乳房圧迫感/乳房痛
めまい
ほてり
食欲減退
月経困難症/月経痛
消化不良
呼吸器系感染症
背部痛
便秘
無排卵出血
胃不快感
喉の痛み
味覚低下
付属器官痛
%(例)
本薬群
(208 例)
CC 群
(209 例)
本薬/CC 群
(209 例)
64.9(135)
23.0(48)
60.3(126)
61.5(128)
39.2(82)
66.0(138)
59.1(123)
52.6(110)
65.6(137)
42.3(88)
44.0(92)
41.6(87)
29.8(62)
13.4(28)
34.4(72)
26.9(56)
21.5(45)
18.7(39)
20.2(42)
18.2(38)
21.5(45)
17.8(37)
18.2(38)
18.7(39)
17.3(36)
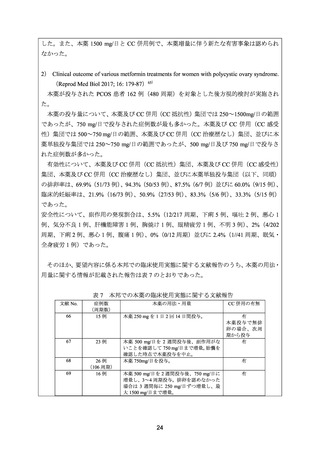
15.3(32)
12.9(27)
17.3(36)
19.6(41)
22.5(47)
16.8(35)
12.4(26)
16.3(34)
15.4(32)
27.8(58)
28.2(59)
13.0(27)
8.1(17)
15.8(33)
12.5(26)
20.1(42)
20.6(43)
11.5(24)
4.3(9)
6.7(14)
11.5(24)
12.9(27)
7.7(16)
10.6(22)
12.0(25)
10.5(22)
10.1(21)
15.3(32)
10.5(22)
8.7(18)
2.9(6)
3.3(7)
7.2(15)
3.8(8)
7.7(16)
6.7(14)
6.2(13)
3.8(8)
5.3(11)
4.8(10)
4.8(10)
1.9(4)
4.8(10)
5.7(12)
注 2)本薬徐放錠が用いられた。なお、要望製剤であるメトグルコ錠は速放錠であるが、本
薬徐放錠の単回投与時の Cmax 及び AUC は同用量の本薬速放錠と大きな違いはないことか
ら、本薬徐放錠を用いた報告も本要望内容における本薬の有効性及び安全性の検討に含め
た。
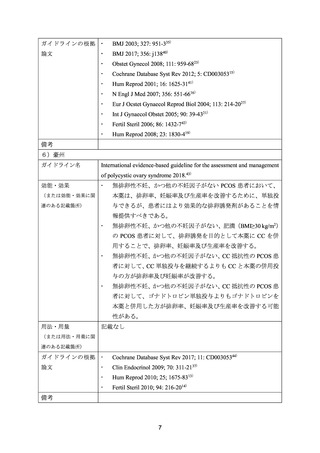
5) Comparison of clomiphene citrate, metformin, or the combination of both for first-line ovulation
induction, achievement of pregnancy, and live birth in Asian women with polycystic ovary syndrome:
a randomized controlled trial.(Fertil Steril 2009; 91: 514-21)17)
PCOS 患者(40 歳未満)を対象に、本薬等の有効性を検討する目的で無作為化非盲検比較試
験が実施された(本薬群 42 例、CC 群 41 例、本薬/CC 群 41 例)
。追跡不能例を除く 115 例(本
薬群 38 例、CC 群 39 例、本薬/CC 群 38 例)が解析対象集団とされた。
本薬の用法・用量は、本薬 500 mg/日から開始し、最初の 3 週間で 1500 mg/日まで増量するこ
ととされた。CC の用法・用量は、CC 50 mg/日を月経周期 2 日目から 5 日間投与し、排卵がな
い場合は段階的に最大 200 mg/日まで増量できる規定とされた。妊娠又は 6 周期まで継続する
こととされた。
有効性について、本薬群、CC 群及び本薬/CC 群(以下、同順)で、排卵率は 23.7%(9/38 例)
、
59%(23/39 例)及び 68.4%(26/38 例)
、妊娠率は 7.9%(3/38 例)
、15.4%(6/39 例)及び 21.1%
(8/38 例)、生産率は 7.9%(3/38 例)
、15.4%(6/39 例)及び 18.4%(7/38 例)であった。
安全性について、本薬の用量を漸増したことにより、本薬の副作用による中止例は認めなか
10
吐き気
腹部痛/腹部不快感
頭痛
嘔吐
腹部膨満感
疲労
鼓腸
気分変化/変動
乳房圧迫感/乳房痛
めまい
ほてり
食欲減退
月経困難症/月経痛
消化不良
呼吸器系感染症
背部痛
便秘
無排卵出血
胃不快感
喉の痛み
味覚低下
付属器官痛
%(例)
本薬群
(208 例)
CC 群
(209 例)
本薬/CC 群
(209 例)
64.9(135)
23.0(48)
60.3(126)
61.5(128)
39.2(82)
66.0(138)
59.1(123)
52.6(110)
65.6(137)
42.3(88)
44.0(92)
41.6(87)
29.8(62)
13.4(28)
34.4(72)
26.9(56)
21.5(45)
18.7(39)
20.2(42)
18.2(38)
21.5(45)
17.8(37)
18.2(38)
18.7(39)
17.3(36)
15.3(32)
12.9(27)
17.3(36)
19.6(41)
22.5(47)
16.8(35)
12.4(26)
16.3(34)
15.4(32)
27.8(58)
28.2(59)
13.0(27)
8.1(17)
15.8(33)
12.5(26)
20.1(42)
20.6(43)
11.5(24)
4.3(9)
6.7(14)
11.5(24)
12.9(27)
7.7(16)
10.6(22)
12.0(25)
10.5(22)
10.1(21)
15.3(32)
10.5(22)
8.7(18)
2.9(6)
3.3(7)
7.2(15)
3.8(8)
7.7(16)
6.7(14)
6.2(13)
3.8(8)
5.3(11)
4.8(10)
4.8(10)
1.9(4)
4.8(10)
5.7(12)
注 2)本薬徐放錠が用いられた。なお、要望製剤であるメトグルコ錠は速放錠であるが、本
薬徐放錠の単回投与時の Cmax 及び AUC は同用量の本薬速放錠と大きな違いはないことか
ら、本薬徐放錠を用いた報告も本要望内容における本薬の有効性及び安全性の検討に含め
た。
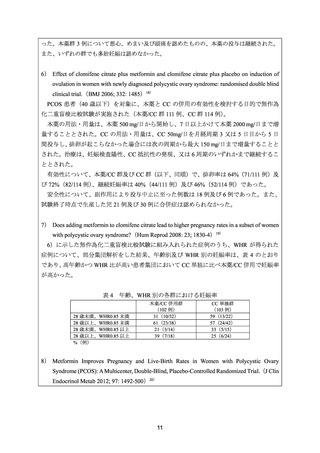
5) Comparison of clomiphene citrate, metformin, or the combination of both for first-line ovulation
induction, achievement of pregnancy, and live birth in Asian women with polycystic ovary syndrome:
a randomized controlled trial.(Fertil Steril 2009; 91: 514-21)17)
PCOS 患者(40 歳未満)を対象に、本薬等の有効性を検討する目的で無作為化非盲検比較試
験が実施された(本薬群 42 例、CC 群 41 例、本薬/CC 群 41 例)
。追跡不能例を除く 115 例(本
薬群 38 例、CC 群 39 例、本薬/CC 群 38 例)が解析対象集団とされた。
本薬の用法・用量は、本薬 500 mg/日から開始し、最初の 3 週間で 1500 mg/日まで増量するこ
ととされた。CC の用法・用量は、CC 50 mg/日を月経周期 2 日目から 5 日間投与し、排卵がな
い場合は段階的に最大 200 mg/日まで増量できる規定とされた。妊娠又は 6 周期まで継続する
こととされた。
有効性について、本薬群、CC 群及び本薬/CC 群(以下、同順)で、排卵率は 23.7%(9/38 例)
、
59%(23/39 例)及び 68.4%(26/38 例)
、妊娠率は 7.9%(3/38 例)
、15.4%(6/39 例)及び 21.1%
(8/38 例)、生産率は 7.9%(3/38 例)
、15.4%(6/39 例)及び 18.4%(7/38 例)であった。
安全性について、本薬の用量を漸増したことにより、本薬の副作用による中止例は認めなか
10