よむ、つかう、まなぶ。
資料2-2 医薬品等の使用上の注意の改訂について (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26332.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第1回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
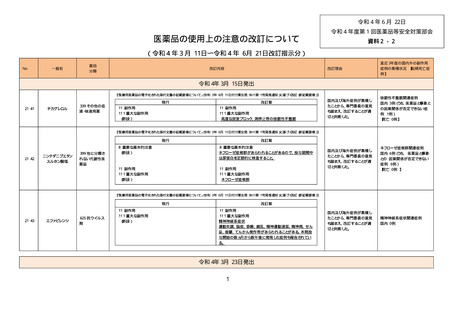
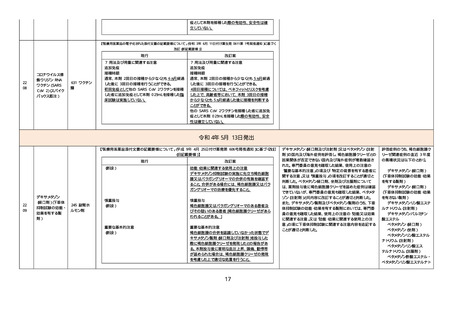
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく
改訂(新記載要領)】
現行
改訂案
(新設)
5. 効能又は効果に関連する注意
〈下垂体抑制試験〉
デキサメタゾン抑制試験の実施に先立ち褐色細胞
腫又はパラガングリオーマの合併の有無を確認す
ること。合併がある場合には、褐色細胞腫又はパラ
ガングリオーマの治療を優先すること。
8. 重要な基本的注意
〈効能共通〉
(新設)
8. 重要な基本的注意
〈効能共通〉
褐色細胞腫の合併を認識していなかった状態でデ
キサメタゾン製剤(経口剤及び注射剤)を投与した
際に褐色細胞腫クリーゼを発現したとの報告があ
る。本剤投与後に著明な血圧上昇、頭痛、動悸等
が認められた場合は、褐色細胞腫クリーゼの発現
を考慮した上で適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
褐色細胞腫又はパラガングリオーマのある患者及
びその疑いのある患者
褐色細胞腫クリーゼがあらわれることがある。
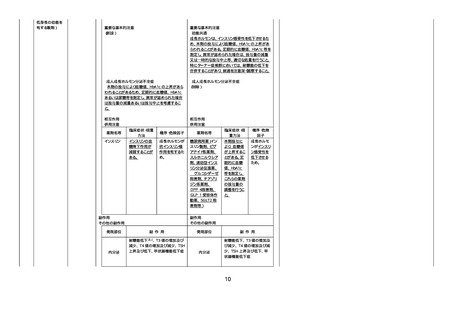
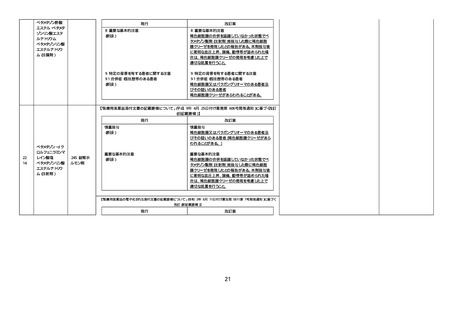
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく
改訂(新記載要領)】
現行
2210
2211
デキサメタゾン
(経口剤)(下垂体
抑制試験の効能・
効果を有さない製
剤)
デキサメタゾンパ
ルミチン酸エステ
ル
8. 重要な基本的注意
褐色細胞腫の合併を認識していなかった状態でデ
キサメタゾン製剤(経口剤及び注射剤)を投与した
際に褐色細胞腫クリーゼを発現したとの報告があ
る。本剤投与後に著明な血圧上昇、頭痛、動悸等
が認められた場合は、褐色細胞腫クリーゼの発現
を考慮した上で適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
褐色細胞腫又はパラガングリオーマのある患者及
びその疑いのある患者
褐色細胞腫クリーゼがあらわれることがある。
245 副腎ホ
ルモン剤
245 副腎ホ
ルモン剤
改訂案
8. 重要な基本的注意
(新設)
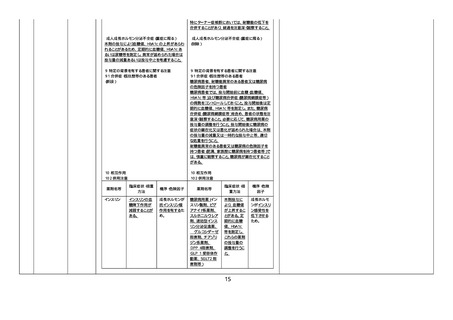
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂
(旧記載要領)】
18
リウム
⑩ ベタメタゾン・d-クロルフェニ
ラミンマレイン酸塩
①
・国内 1 例(うち、医薬品と事
象との因果関係が否定できな
い症例 0 例)【死亡 0 例】
・海外 1 例(うち、医薬品と事
象との因果関係が否定できな
い症例 0 例)【死亡 0 例】
⑦
・国内 1 例(うち、医薬品と事
象との因果関係が否定できな
い症例 1 例)【死亡 0 例】
・海外 1 例(うち、医薬品と事
象との因果関係が否定できな
い症例 1 例)【死亡 0 例】
②〜⑥、⑧〜⑩
・国内及び海外 0 例
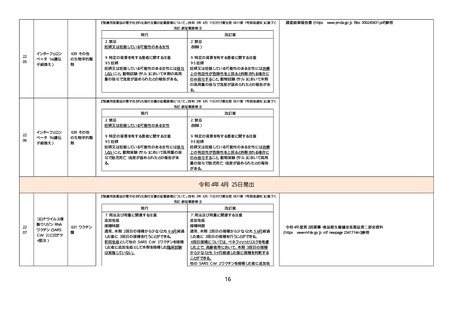
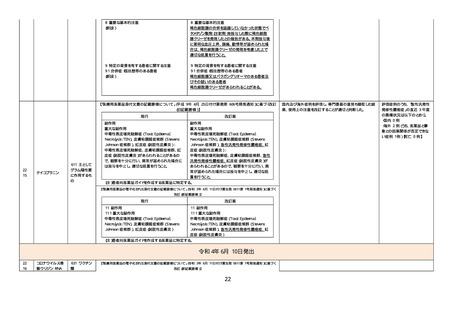
改訂(新記載要領)】
現行
改訂案
(新設)
5. 効能又は効果に関連する注意
〈下垂体抑制試験〉
デキサメタゾン抑制試験の実施に先立ち褐色細胞
腫又はパラガングリオーマの合併の有無を確認す
ること。合併がある場合には、褐色細胞腫又はパラ
ガングリオーマの治療を優先すること。
8. 重要な基本的注意
〈効能共通〉
(新設)
8. 重要な基本的注意
〈効能共通〉
褐色細胞腫の合併を認識していなかった状態でデ
キサメタゾン製剤(経口剤及び注射剤)を投与した
際に褐色細胞腫クリーゼを発現したとの報告があ
る。本剤投与後に著明な血圧上昇、頭痛、動悸等
が認められた場合は、褐色細胞腫クリーゼの発現
を考慮した上で適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
褐色細胞腫又はパラガングリオーマのある患者及
びその疑いのある患者
褐色細胞腫クリーゼがあらわれることがある。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和 3 年 6 月 11 日付け薬生発 0611 第 1 号局長通知)に基づく
改訂(新記載要領)】
現行
2210
2211
デキサメタゾン
(経口剤)(下垂体
抑制試験の効能・
効果を有さない製
剤)
デキサメタゾンパ
ルミチン酸エステ
ル
8. 重要な基本的注意
褐色細胞腫の合併を認識していなかった状態でデ
キサメタゾン製剤(経口剤及び注射剤)を投与した
際に褐色細胞腫クリーゼを発現したとの報告があ
る。本剤投与後に著明な血圧上昇、頭痛、動悸等
が認められた場合は、褐色細胞腫クリーゼの発現
を考慮した上で適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
褐色細胞腫又はパラガングリオーマのある患者及
びその疑いのある患者
褐色細胞腫クリーゼがあらわれることがある。
245 副腎ホ
ルモン剤
245 副腎ホ
ルモン剤
改訂案
8. 重要な基本的注意
(新設)
【「医療用医薬品添付文書の記載要領について」(平成 9 年 4 月 25 日付け薬発第 606 号局長通知)に基づく改訂
(旧記載要領)】
18
リウム
⑩ ベタメタゾン・d-クロルフェニ
ラミンマレイン酸塩
①
・国内 1 例(うち、医薬品と事
象との因果関係が否定できな
い症例 0 例)【死亡 0 例】
・海外 1 例(うち、医薬品と事
象との因果関係が否定できな
い症例 0 例)【死亡 0 例】
⑦
・国内 1 例(うち、医薬品と事
象との因果関係が否定できな
い症例 1 例)【死亡 0 例】
・海外 1 例(うち、医薬品と事
象との因果関係が否定できな
い症例 1 例)【死亡 0 例】
②〜⑥、⑧〜⑩
・国内及び海外 0 例