よむ、つかう、まなぶ。
難病「アミロイドーシス」に光を。-アミロイドの無毒化による治療効果を初めて実証- (2 ページ)
出典
| 公開元URL | https://www.u-tokyo.ac.jp/focus/ja/press/z0111_00087.html |
| 出典情報 | 難病「アミロイドーシス」に光を。-アミロイドの無毒化による治療効果を初めて実証-(8/7)《東京大学ほか》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
概要
東京大学 大学院薬学系研究科 有機合成化学教室 金井 求 教授と山根 三奈 特任助教らの
研究グループは、同・機能病態教室 富田 泰輔 教授、堀 由起子 准教授、熊本大学 発生医学
研究所 山中 邦俊 准教授、筑波大学 医学医療系/トランスボーダー医学研究センター 広川
貴次 教授、京都大学 化学研究所 梶 弘典 教授、和歌山県立医科大学 相馬 洋平 教授、杉村
会 杉村病院アミロイドーシス診療研究サポートセンター 安東 由喜雄
総長、熊本大学 大学
院生命科学研究部 植田 光晴 教授、富山大学 学術研究部 薬学・和漢系(薬学)構造生物学
研究室 水口 峰之 教授の研究グループと共同で、難病「トランスサイレチンアミロイドーシ
ス(ATTR)」に対し、新たな治療戦略を打ち出しました。
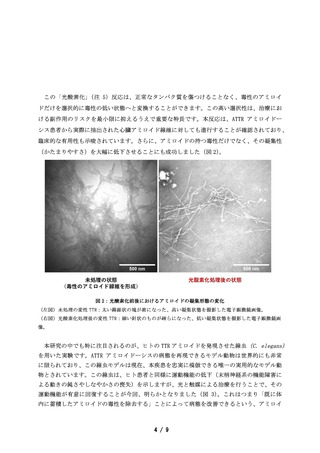
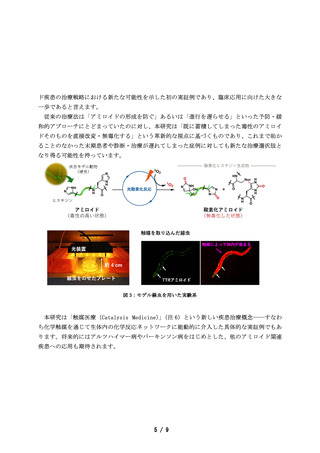
本技術の鍵となった触媒は、光と空気中の酸素を使った化学反応(光酸素化)により、疾患
モデル動物個体内で毒性のアミロイドを無毒化することができ、治療効果を観察することに初
めて成功しました。
従来の治療法は、早期患者の症状を和らげ進行を遅らせる、または健常者の発病予防に対し
てある程度の効果が見込めていました。しかしながら、ある一定のステージまで病気が進行し
た患者に対しては、体内に蓄積したアミロイドを無毒化・分解する効能はありませんでした。
一方、本研究の特色である「アミロイド選択的な光酸素化」は、アミロイドの形成阻害に加え、
不可逆的に沈着したアミロイドを化学反応により選択的に無毒化することで、動物個体で病態
改善を実現可能とする小分子触媒の世界初の例となります。これまでに金井教授らは、アルツ
ハイマー型認知症の原因物質(アミロイド β やタウ)を対象として種々の光酸素化触媒を開発
してきましたが、臨床応用には至っていませんでした。本研究は、課題としていた治療効果の
概念実証獲得を克服し、触媒的光酸素化法を臨床適用に繋げるマイルストーンを達成したと共
に、これまで治療法が無かった患者にも有効な特効薬の開発につながることが期待されます。
発表内容
タンパク質の誤った折りたたみ(ミスフォールディング)とそれによる凝集は、加齢にとも
なって起こるタンパク質異常の代表的な現象です。特に、それらが不溶性の線維状構造となっ
たものはアミロイド(注 1)と呼ばれ、高い毒性を有することで知られています。アミロイド
は体内で分解されにくく、組織や臓器に沈着することで様々な病気を引き起こす原因となりま
す。例として、アルツハイマー病やパーキンソン病、筋萎縮性側索硬化症(ALS)、2 型糖尿病、
そして全身性アミロイドーシス(注 2)など多岐にわたります。世界保健機関(WHO)の予測
によれば、こうしたアミロイド疾患は 2040 年までにがんを超えて死因の第 2 位に入るとされ
ています。
2 / 9
東京大学 大学院薬学系研究科 有機合成化学教室 金井 求 教授と山根 三奈 特任助教らの
研究グループは、同・機能病態教室 富田 泰輔 教授、堀 由起子 准教授、熊本大学 発生医学
研究所 山中 邦俊 准教授、筑波大学 医学医療系/トランスボーダー医学研究センター 広川
貴次 教授、京都大学 化学研究所 梶 弘典 教授、和歌山県立医科大学 相馬 洋平 教授、杉村
会 杉村病院アミロイドーシス診療研究サポートセンター 安東 由喜雄
総長、熊本大学 大学
院生命科学研究部 植田 光晴 教授、富山大学 学術研究部 薬学・和漢系(薬学)構造生物学
研究室 水口 峰之 教授の研究グループと共同で、難病「トランスサイレチンアミロイドーシ
ス(ATTR)」に対し、新たな治療戦略を打ち出しました。
本技術の鍵となった触媒は、光と空気中の酸素を使った化学反応(光酸素化)により、疾患
モデル動物個体内で毒性のアミロイドを無毒化することができ、治療効果を観察することに初
めて成功しました。
従来の治療法は、早期患者の症状を和らげ進行を遅らせる、または健常者の発病予防に対し
てある程度の効果が見込めていました。しかしながら、ある一定のステージまで病気が進行し
た患者に対しては、体内に蓄積したアミロイドを無毒化・分解する効能はありませんでした。
一方、本研究の特色である「アミロイド選択的な光酸素化」は、アミロイドの形成阻害に加え、
不可逆的に沈着したアミロイドを化学反応により選択的に無毒化することで、動物個体で病態
改善を実現可能とする小分子触媒の世界初の例となります。これまでに金井教授らは、アルツ
ハイマー型認知症の原因物質(アミロイド β やタウ)を対象として種々の光酸素化触媒を開発
してきましたが、臨床応用には至っていませんでした。本研究は、課題としていた治療効果の
概念実証獲得を克服し、触媒的光酸素化法を臨床適用に繋げるマイルストーンを達成したと共
に、これまで治療法が無かった患者にも有効な特効薬の開発につながることが期待されます。
発表内容
タンパク質の誤った折りたたみ(ミスフォールディング)とそれによる凝集は、加齢にとも
なって起こるタンパク質異常の代表的な現象です。特に、それらが不溶性の線維状構造となっ
たものはアミロイド(注 1)と呼ばれ、高い毒性を有することで知られています。アミロイド
は体内で分解されにくく、組織や臓器に沈着することで様々な病気を引き起こす原因となりま
す。例として、アルツハイマー病やパーキンソン病、筋萎縮性側索硬化症(ALS)、2 型糖尿病、
そして全身性アミロイドーシス(注 2)など多岐にわたります。世界保健機関(WHO)の予測
によれば、こうしたアミロイド疾患は 2040 年までにがんを超えて死因の第 2 位に入るとされ
ています。
2 / 9