よむ、つかう、まなぶ。
総-6 参考2[411KB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58800.html |
| 出典情報 | 中央社会保険医療協議会 総会(第609回 6/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
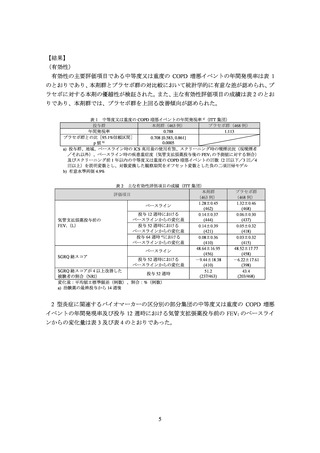
表 3 2 型炎症に関連するバイオマーカーの区分別の中等度又は重度の COPD 増悪イベントの年間発現率(ITT 集団)
プラセボ群との比 a)
2 型炎症に関連するバイオマーカーの区分
本剤群
プラセボ群
[95%信頼区間]
1.11 (468)
全体集団
0.79 (463)
0.708 [0.583, 0.860]
0.78 (307)
0.98 (295)
500/µL 未満
0.797 [0.637, 0.997]
スクリーニング期間の
0.40 (156)
0.85 (173)
最大血中好酸球数
500/µL 以上
0.512 [0.350, 0.748]
0.71 (238)
0.85 (253)
20 ppb 未満
0.854 [0.663, 1.100]
ベースラインの FeNO
0.60 (190)
1.00 (186)
20 ppb 以上
0.639 [0.460, 0.888]
0.73 (194)
0.80 (211)
100 IU/mL 未満
0.908 [0.689, 1.195]
ベースラインの
0.59 (244)
1.10 (230)
血清中総 IgE 濃度
100 IU/mL 以上
0.574 [0.432, 0.762]
0.71 (233)
1.00 (223)
中央値(151 pg/mL)未満
0.702 [0.538, 0.915]
ベースラインの
0.61 (223)
0.88 (242)
血漿中エオタキシン-3 濃度
中央値(151 pg/mL)以上
0.720 [0.540, 0.960]
0.70 (222)
0.99 (231)
中央値(72.3 ng/mL)未満
0.669 [0.512, 0.876]
ベースラインの
0.63 (230)
0.90 (228)
血清中 PARC
中央値(72.3 ng/mL)以上
0.762 [0.573, 1.014]
回/人・年(例数)
a) 投与群、地域、ベースライン時の ICS 高用量の使用有無、スクリーニング時の喫煙状況(現喫煙者/それ以外)
、ベースラ
イン時の疾患重症度(気管支拡張薬投与後の FEV1 の予測値に対する割合)及びスクリーニング前 1 年以内の中等度又は重
度の COPD 増悪イベントの回数(2 回以下/3 回/4 回以上)
(対象とする部分集団に関する変数を除く)を説明変数とし、
対数変換した観察期間をオフセット変数とした負の二項回帰モデル
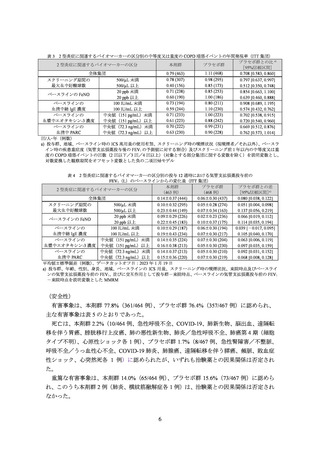
表 4 2 型炎症に関連するバイオマーカーの区分別の投与 12 週時における気管支拡張薬投与前の
FEV1(L)のベースラインからの変化量(ITT 集団)
本剤群
プラセボ群
プラセボ群との差
2 型炎症に関連するバイオマーカーの区分
(463 例)
(468 例)
[95%信頼区間]a)
全体集団
0.14±0.37 (444)
0.06±0.30 (437)
0.080 [0.038, 0.122]
500/µL 未満
0.10±0.32 (295)
0.05±0.28 (274)
0.051 [0.004, 0.098]
スクリーニング期間の
最大血中好酸球数
500/µL 以上
0.23±0.44 (149)
0.07±0.34 (163)
0.137 [0.056, 0.219]
20 ppb 未満
0.09±0.29 (226)
0.02±0.23 (236)
0.066 [0.019, 0.112]
ベースラインの FeNO
20 ppb 以上
0.22±0.45 (183)
0.10±0.37 (175)
0.114 [0.035, 0.194]
100 IU/mL 未満
0.10±0.29 (187)
0.06±0.30 (194)
0.039 [-0.017, 0.095]
ベースラインの
血清中総 IgE 濃度
100 IU/mL 以上
0.19±0.43 (234)
0.07±0.30 (217)
0.105 [0.040, 0.170]
中央値(151 pg/mL)未満
0.14±0.35 (224)
0.07±0.30 (204)
0.063 [0.006, 0.119]
ベースラインの
血漿中エオタキシン-3 濃度 中央値(151 pg/mL)以上
0.16±0.38 (213)
0.05±0.30 (230)
0.097 [0.035, 0.159]
中央値(72.3 ng/mL)未満
0.14±0.37 (213)
0.05±0.30 (210)
0.092 [0.031, 0.152]
ベースラインの
血清中 PARC
中央値(72.3 ng/mL)以上
0.15±0.36 (220)
0.07±0.30 (219)
0.068 [0.008, 0.128]
平均値±標準偏差(例数)
、データカットオフ日:2023 年 1 月 19 日
a) 投与群、年齢、性別、身長、地域、ベースラインの ICS 用量、スクリーニング時の喫煙状況、来院時点及びベースライ
ンの気管支拡張薬投与前の FEV1、並びに交互作用として投与群-来院時点、ベースラインの気管支拡張薬投与前の FEV1
-来院時点を説明変数とした MMRM
(安全性)
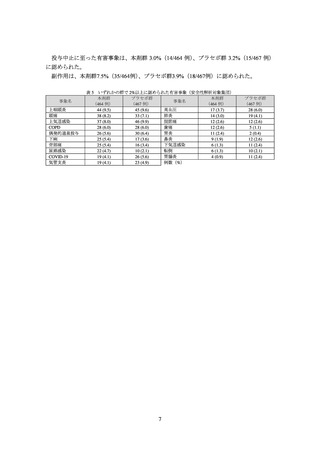
有害事象は、本剤群 77.8%(361/464 例)、プラセボ群 76.4%(357/467 例)に認められ、
主な有害事象は表 5 のとおりであった。
死亡は、本剤群 2.2%(10/464 例、急性呼吸不全、COVID-19、肺新生物、脳出血、遠隔転
移を伴う胃癌、膀胱移行上皮癌、肺の悪性新生物、肺炎/急性呼吸不全、肺癌第 4 期(細胞
タイプ不明)
、心原性ショック各 1 例)、プラセボ群 1.7%(8/467 例、急性腎障害/不整脈、
呼吸不全/うっ血性心不全、COVID-19 肺炎、肺腺癌、遠隔転移を伴う膵癌、頻脈、敗血症
性ショック、心突然死各 1 例)に認められたが、いずれも治験薬との因果関係は否定され
た。
重篤な有害事象は、本剤群 14.0%(65/464 例)、プラセボ群 15.6%(73/467 例)に認めら
れ、このうち本剤群 2 例(肺炎、横紋筋融解症各 1 例)は、治験薬との因果関係は否定され
なかった。
6
プラセボ群との比 a)
2 型炎症に関連するバイオマーカーの区分
本剤群
プラセボ群
[95%信頼区間]
1.11 (468)
全体集団
0.79 (463)
0.708 [0.583, 0.860]
0.78 (307)
0.98 (295)
500/µL 未満
0.797 [0.637, 0.997]
スクリーニング期間の
0.40 (156)
0.85 (173)
最大血中好酸球数
500/µL 以上
0.512 [0.350, 0.748]
0.71 (238)
0.85 (253)
20 ppb 未満
0.854 [0.663, 1.100]
ベースラインの FeNO
0.60 (190)
1.00 (186)
20 ppb 以上
0.639 [0.460, 0.888]
0.73 (194)
0.80 (211)
100 IU/mL 未満
0.908 [0.689, 1.195]
ベースラインの
0.59 (244)
1.10 (230)
血清中総 IgE 濃度
100 IU/mL 以上
0.574 [0.432, 0.762]
0.71 (233)
1.00 (223)
中央値(151 pg/mL)未満
0.702 [0.538, 0.915]
ベースラインの
0.61 (223)
0.88 (242)
血漿中エオタキシン-3 濃度
中央値(151 pg/mL)以上
0.720 [0.540, 0.960]
0.70 (222)
0.99 (231)
中央値(72.3 ng/mL)未満
0.669 [0.512, 0.876]
ベースラインの
0.63 (230)
0.90 (228)
血清中 PARC
中央値(72.3 ng/mL)以上
0.762 [0.573, 1.014]
回/人・年(例数)
a) 投与群、地域、ベースライン時の ICS 高用量の使用有無、スクリーニング時の喫煙状況(現喫煙者/それ以外)
、ベースラ
イン時の疾患重症度(気管支拡張薬投与後の FEV1 の予測値に対する割合)及びスクリーニング前 1 年以内の中等度又は重
度の COPD 増悪イベントの回数(2 回以下/3 回/4 回以上)
(対象とする部分集団に関する変数を除く)を説明変数とし、
対数変換した観察期間をオフセット変数とした負の二項回帰モデル
表 4 2 型炎症に関連するバイオマーカーの区分別の投与 12 週時における気管支拡張薬投与前の
FEV1(L)のベースラインからの変化量(ITT 集団)
本剤群
プラセボ群
プラセボ群との差
2 型炎症に関連するバイオマーカーの区分
(463 例)
(468 例)
[95%信頼区間]a)
全体集団
0.14±0.37 (444)
0.06±0.30 (437)
0.080 [0.038, 0.122]
500/µL 未満
0.10±0.32 (295)
0.05±0.28 (274)
0.051 [0.004, 0.098]
スクリーニング期間の
最大血中好酸球数
500/µL 以上
0.23±0.44 (149)
0.07±0.34 (163)
0.137 [0.056, 0.219]
20 ppb 未満
0.09±0.29 (226)
0.02±0.23 (236)
0.066 [0.019, 0.112]
ベースラインの FeNO
20 ppb 以上
0.22±0.45 (183)
0.10±0.37 (175)
0.114 [0.035, 0.194]
100 IU/mL 未満
0.10±0.29 (187)
0.06±0.30 (194)
0.039 [-0.017, 0.095]
ベースラインの
血清中総 IgE 濃度
100 IU/mL 以上
0.19±0.43 (234)
0.07±0.30 (217)
0.105 [0.040, 0.170]
中央値(151 pg/mL)未満
0.14±0.35 (224)
0.07±0.30 (204)
0.063 [0.006, 0.119]
ベースラインの
血漿中エオタキシン-3 濃度 中央値(151 pg/mL)以上
0.16±0.38 (213)
0.05±0.30 (230)
0.097 [0.035, 0.159]
中央値(72.3 ng/mL)未満
0.14±0.37 (213)
0.05±0.30 (210)
0.092 [0.031, 0.152]
ベースラインの
血清中 PARC
中央値(72.3 ng/mL)以上
0.15±0.36 (220)
0.07±0.30 (219)
0.068 [0.008, 0.128]
平均値±標準偏差(例数)
、データカットオフ日:2023 年 1 月 19 日
a) 投与群、年齢、性別、身長、地域、ベースラインの ICS 用量、スクリーニング時の喫煙状況、来院時点及びベースライ
ンの気管支拡張薬投与前の FEV1、並びに交互作用として投与群-来院時点、ベースラインの気管支拡張薬投与前の FEV1
-来院時点を説明変数とした MMRM
(安全性)
有害事象は、本剤群 77.8%(361/464 例)、プラセボ群 76.4%(357/467 例)に認められ、
主な有害事象は表 5 のとおりであった。
死亡は、本剤群 2.2%(10/464 例、急性呼吸不全、COVID-19、肺新生物、脳出血、遠隔転
移を伴う胃癌、膀胱移行上皮癌、肺の悪性新生物、肺炎/急性呼吸不全、肺癌第 4 期(細胞
タイプ不明)
、心原性ショック各 1 例)、プラセボ群 1.7%(8/467 例、急性腎障害/不整脈、
呼吸不全/うっ血性心不全、COVID-19 肺炎、肺腺癌、遠隔転移を伴う膵癌、頻脈、敗血症
性ショック、心突然死各 1 例)に認められたが、いずれも治験薬との因果関係は否定され
た。
重篤な有害事象は、本剤群 14.0%(65/464 例)、プラセボ群 15.6%(73/467 例)に認めら
れ、このうち本剤群 2 例(肺炎、横紋筋融解症各 1 例)は、治験薬との因果関係は否定され
なかった。
6