よむ、つかう、まなぶ。
総-6 参考1[551KB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58800.html |
| 出典情報 | 中央社会保険医療協議会 総会(第609回 6/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
② 国際共同第Ⅲ相試験(ADRIATIC 試験)
根治的同時化学放射線療法 *1 後に疾患進行が認められない限局型小細胞肺癌患者
(WHO/ECOG Performance Status 0 又は 1)530 例(本剤群 264 例、プラセボ群 266 例)
(日本人 50 例[本剤群 19 例、プラセボ群 31 例]を含む)を対象に、化学放射線療法
終了後 42 日以内に本剤又はプラセボを投与した場合の有効性及び安全性を検討した。
用法・用量は、本剤 1,500 mg 又はプラセボを 4 週間間隔で静脈内投与することとされ、
疾患進行若しくは投与中止基準に該当するまで又は最大 24 カ月間(26 サイクル)投与
を継続することとされた。
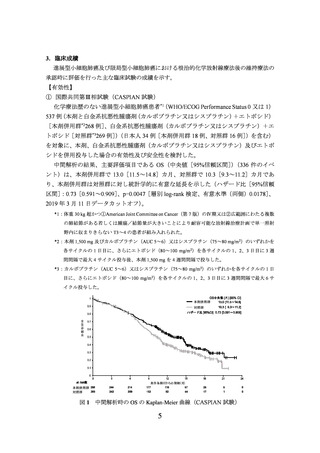
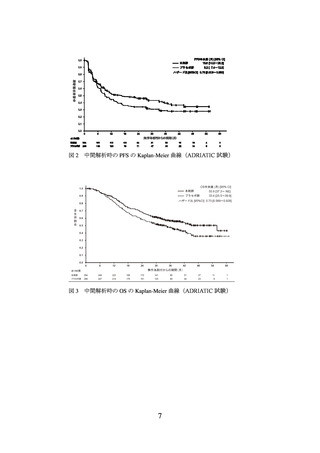
中間解析の結果、主要評価項目の一つである盲検下独立中央評価判定による無増悪
生存期間(以下、
「PFS」)
(308 件のイベント)の結果について、本剤群はプラセボ群に
対し統計学的に有意な延長を示した(ハザード比[95%信頼区間]
:0.76[0.606~0.950]
、
p=0.01608[層別 log-rank 検定、有意水準(両側)0.02805]
、2024 年 1 月 15 日データカ
ットオフ)
。PFS の中央値[95%信頼区間]は、本剤群で 16.6[10.2~28.2]カ月、プラ
セボ群で 9.2[7.4~12.9]カ月であった。
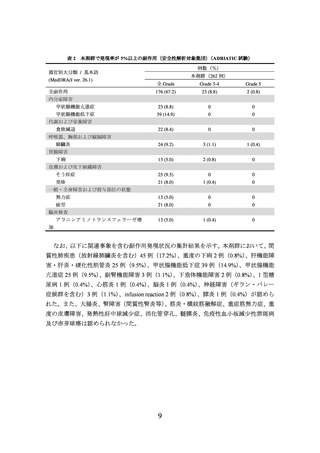
また、もう一つの主要評価項目である全生存期間(以下、
「OS」
)
(261 件のイベント)
について、本剤群はプラセボ群に対し統計学的に有意な延長を示した(ハザード比[95%
信頼区間]
:0.73
[0.569~0.928]、p=0.01042
[層別 log-rank 検定、有意水準(両側)0.01679]
)、
2024 年 1 月 15 日データカットオフ)。OS の中央値[95%信頼区間]は、本剤群で 55.9
[37.3~NE*2]カ月、プラセボ群で 33.4[25.5~39.9]カ月であった。
*1:体重 30kg 超かつ American Joint Committee on Cancer(AJCC)/(UICC)
(第 8 版)に基づく臨床病
期Ⅰ~Ⅲ期の患者(Ⅰ又はⅡ期の場合は医学的に切除不能な患者)が組み入れられた。化学療法と
して、白金系抗悪性腫瘍剤(シスプラチン又はカルボプラチン)とエトポシドとの併用投与を 4 サ
イクル繰り返し投与した。放射線療法として、6 週間で総線量 60~66 Gy を投与する 1 日 1 回の通
常分割照射法又は 3 週間で総線量 45 Gy を投与する 1 日 2 回の加速過分割照射法のいずれかを選択
した。予防的全脳照射は治験担当医師の判断で実施可能とされ、化学放射線療法施行後に実施し、
無作為化及び治験薬の初回投与前 1~42 日以内に完了することとした。
*2:推定不能
6
根治的同時化学放射線療法 *1 後に疾患進行が認められない限局型小細胞肺癌患者
(WHO/ECOG Performance Status 0 又は 1)530 例(本剤群 264 例、プラセボ群 266 例)
(日本人 50 例[本剤群 19 例、プラセボ群 31 例]を含む)を対象に、化学放射線療法
終了後 42 日以内に本剤又はプラセボを投与した場合の有効性及び安全性を検討した。
用法・用量は、本剤 1,500 mg 又はプラセボを 4 週間間隔で静脈内投与することとされ、
疾患進行若しくは投与中止基準に該当するまで又は最大 24 カ月間(26 サイクル)投与
を継続することとされた。
中間解析の結果、主要評価項目の一つである盲検下独立中央評価判定による無増悪
生存期間(以下、
「PFS」)
(308 件のイベント)の結果について、本剤群はプラセボ群に
対し統計学的に有意な延長を示した(ハザード比[95%信頼区間]
:0.76[0.606~0.950]
、
p=0.01608[層別 log-rank 検定、有意水準(両側)0.02805]
、2024 年 1 月 15 日データカ
ットオフ)
。PFS の中央値[95%信頼区間]は、本剤群で 16.6[10.2~28.2]カ月、プラ
セボ群で 9.2[7.4~12.9]カ月であった。
また、もう一つの主要評価項目である全生存期間(以下、
「OS」
)
(261 件のイベント)
について、本剤群はプラセボ群に対し統計学的に有意な延長を示した(ハザード比[95%
信頼区間]
:0.73
[0.569~0.928]、p=0.01042
[層別 log-rank 検定、有意水準(両側)0.01679]
)、
2024 年 1 月 15 日データカットオフ)。OS の中央値[95%信頼区間]は、本剤群で 55.9
[37.3~NE*2]カ月、プラセボ群で 33.4[25.5~39.9]カ月であった。
*1:体重 30kg 超かつ American Joint Committee on Cancer(AJCC)/(UICC)
(第 8 版)に基づく臨床病
期Ⅰ~Ⅲ期の患者(Ⅰ又はⅡ期の場合は医学的に切除不能な患者)が組み入れられた。化学療法と
して、白金系抗悪性腫瘍剤(シスプラチン又はカルボプラチン)とエトポシドとの併用投与を 4 サ
イクル繰り返し投与した。放射線療法として、6 週間で総線量 60~66 Gy を投与する 1 日 1 回の通
常分割照射法又は 3 週間で総線量 45 Gy を投与する 1 日 2 回の加速過分割照射法のいずれかを選択
した。予防的全脳照射は治験担当医師の判断で実施可能とされ、化学放射線療法施行後に実施し、
無作為化及び治験薬の初回投与前 1~42 日以内に完了することとした。
*2:推定不能
6