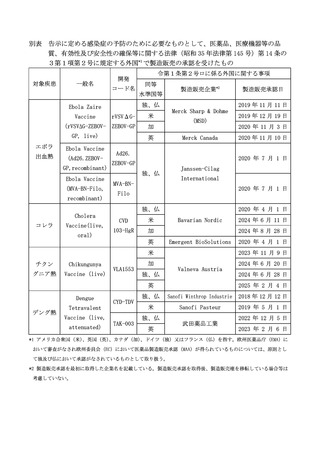
よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律施行令第1条第2号ロの規定に基づき感染症の予防のために必要なものとして厚生労働大臣が定める核酸等に関する告示について[1.1MB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
当技術
☐核酸等以外の遺伝子の発現と密接な関係を有する物(細
胞の核の外にあるものを除く。)として厚生労働省令で定め
る物を加工するための機能を有する物
☐上記に掲げる物を含有する物(細胞の分泌物を除く。)
添付書類
☐医薬品に用いられた技術の詳細
☐感染症の予防のために必要なものと考えるに至った客観的事実等
☐遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(平成
15 年法律第 97 号)に規定される遺伝子組換え生物等の該当性の有無及びその根拠
☐その他
2
提案者の連絡先
提案者の氏名
所属
役職
電話番号
電子メールアドレス
(留意事項)
1
用紙の大きさは、A4とすること。
2
提出は、正副2通とすること。
3
各項目の記載欄にその記載事項の全てを記載する事ができないときには、同欄に「別紙のとおり。
」と記載し、別紙
を添付すること。
4
製造販売承認されている国の名称は、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行令第
28 条第1項で規定される特定承認制度における同等水準国(アメリカ合衆国、英国、カナダ、ドイツ又はフランス)に
限る。欧州医薬品庁(EMA)において審査がなされ欧州委員会(EC)において医薬品製造販売承認(MAA)が得られてい
るものについては、原則としてドイツ及びフランスにおいて承認がなされているものとして取り扱う。
5
提案可能な医薬品は感染症の予防を目的とするものに限る。
6
医薬品に用いられた技術の詳細技術の詳細には、当該医薬品に用いられる核酸等の作用機序や体内動態、製造管理や
品質管理の基準、安全性及び有効性等の科学的根拠の詳細について具体的に記載すること(様式自由)
。
7
遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(平成 15 年法律第 97 号)に規定される
遺伝子組換え生物等に該当する場合は、令第1条第2号ロに該当する場合であっても、別途、第一種使用規程の承認を
得る必要がある場合がある。
8
本様式及び添付書類の内容については、厚生科学審議会における議論に使用され、公開される可能性がある。
2
参考
☐核酸等以外の遺伝子の発現と密接な関係を有する物(細
胞の核の外にあるものを除く。)として厚生労働省令で定め
る物を加工するための機能を有する物
☐上記に掲げる物を含有する物(細胞の分泌物を除く。)
添付書類
☐医薬品に用いられた技術の詳細
☐感染症の予防のために必要なものと考えるに至った客観的事実等
☐遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(平成
15 年法律第 97 号)に規定される遺伝子組換え生物等の該当性の有無及びその根拠
☐その他
2
提案者の連絡先
提案者の氏名
所属
役職
電話番号
電子メールアドレス
(留意事項)
1
用紙の大きさは、A4とすること。
2
提出は、正副2通とすること。
3
各項目の記載欄にその記載事項の全てを記載する事ができないときには、同欄に「別紙のとおり。
」と記載し、別紙
を添付すること。
4
製造販売承認されている国の名称は、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行令第
28 条第1項で規定される特定承認制度における同等水準国(アメリカ合衆国、英国、カナダ、ドイツ又はフランス)に
限る。欧州医薬品庁(EMA)において審査がなされ欧州委員会(EC)において医薬品製造販売承認(MAA)が得られてい
るものについては、原則としてドイツ及びフランスにおいて承認がなされているものとして取り扱う。
5
提案可能な医薬品は感染症の予防を目的とするものに限る。
6
医薬品に用いられた技術の詳細技術の詳細には、当該医薬品に用いられる核酸等の作用機序や体内動態、製造管理や
品質管理の基準、安全性及び有効性等の科学的根拠の詳細について具体的に記載すること(様式自由)
。
7
遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(平成 15 年法律第 97 号)に規定される
遺伝子組換え生物等に該当する場合は、令第1条第2号ロに該当する場合であっても、別途、第一種使用規程の承認を
得る必要がある場合がある。
8
本様式及び添付書類の内容については、厚生科学審議会における議論に使用され、公開される可能性がある。
2
参考