よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律施行令第1条第2号ロの規定に基づき感染症の予防のために必要なものとして厚生労働大臣が定める核酸等に関する告示について[1.1MB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
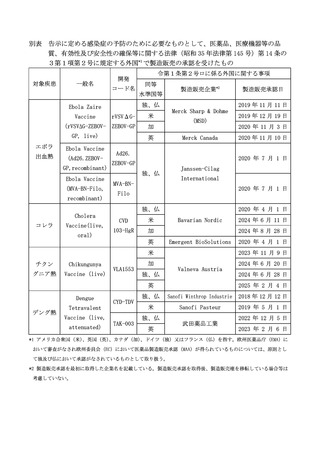
企業の名称及び所在地、外国における製造販売承認の詳細(承認されている国の名称、
承認を与えた外国機関の名称、承認日、予防の適応を有する疾患名、令 別表(第1条第
2号関係)に掲げる技術への該当性について記載するとともに、医薬品に用いられた技
術の詳細、感染症の予防のために必要なものと考えるに至った客観的事実等、カルタヘ
ナ法に規定される遺伝子組換え生物等の該当性の有無及びその根拠について、書類(様
式自由)を添付して以下の連絡先宛に提出すること。
提案書(別紙様式)提出先:
以下の2つの連絡先を宛先として、別紙様式及び添付書類を電子メールにて提出する
こと。
医政局研究開発政策課再生医療等研究推進室 saiseishitsu※mhlw.go.jp
健康・生活衛生局感染症対策部感染症対策課
kansensho※mhlw.go.jp
※スパムメール防止のため、@を※としている。送信の際には、@(半角)に変換する
こと。
※判別のため、件名は「再生医療等安全性確保法施行令第1条第2号ロの規定に基づ
き感染症の予防のために必要なものとして厚生労働大臣が定める核酸等に関する告
示に関する意見」と明記すること。
なお、提出された提案については、すべからく厚生科学審議会における審議の対象と
するものではなく、公衆衛生上の必要性や当該医薬品の安全性や有効性の観点等を踏ま
え、法の趣旨に鑑み明らかに不適切と考えられるものについては検討しないこともあり
うるため留意されたい。
承認を与えた外国機関の名称、承認日、予防の適応を有する疾患名、令 別表(第1条第
2号関係)に掲げる技術への該当性について記載するとともに、医薬品に用いられた技
術の詳細、感染症の予防のために必要なものと考えるに至った客観的事実等、カルタヘ
ナ法に規定される遺伝子組換え生物等の該当性の有無及びその根拠について、書類(様
式自由)を添付して以下の連絡先宛に提出すること。
提案書(別紙様式)提出先:
以下の2つの連絡先を宛先として、別紙様式及び添付書類を電子メールにて提出する
こと。
医政局研究開発政策課再生医療等研究推進室 saiseishitsu※mhlw.go.jp
健康・生活衛生局感染症対策部感染症対策課
kansensho※mhlw.go.jp
※スパムメール防止のため、@を※としている。送信の際には、@(半角)に変換する
こと。
※判別のため、件名は「再生医療等安全性確保法施行令第1条第2号ロの規定に基づ
き感染症の予防のために必要なものとして厚生労働大臣が定める核酸等に関する告
示に関する意見」と明記すること。
なお、提出された提案については、すべからく厚生科学審議会における審議の対象と
するものではなく、公衆衛生上の必要性や当該医薬品の安全性や有効性の観点等を踏ま
え、法の趣旨に鑑み明らかに不適切と考えられるものについては検討しないこともあり
うるため留意されたい。