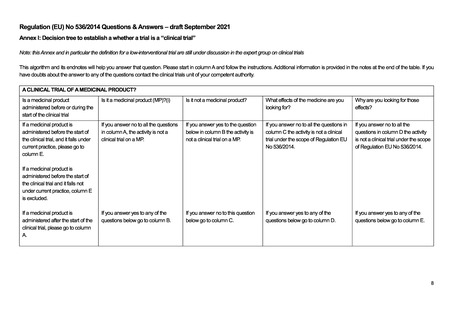
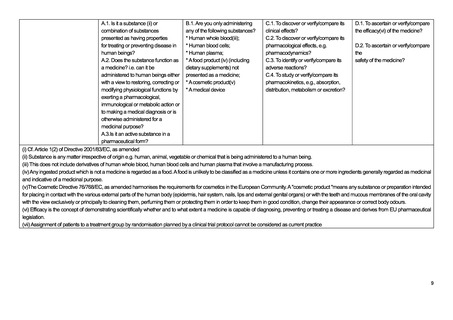
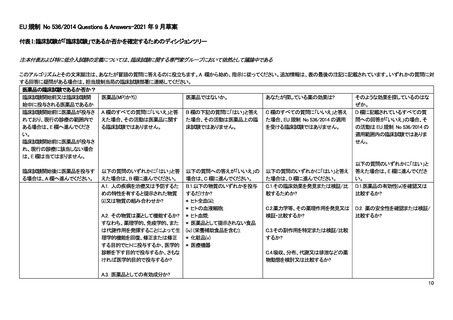
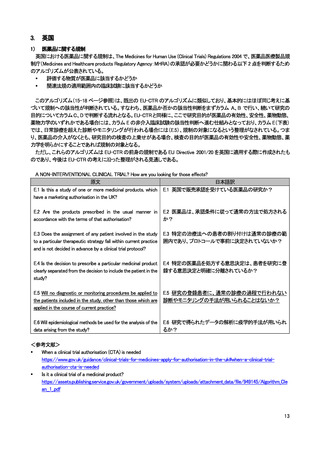
よむ、つかう、まなぶ。
参考資料1-2: 令和3年度厚生労働科学特別研究事業「臨床研究法の見直しの審議における新たな課題・論点への対応策の確立のための研究」班 欧米での観察研究の取り扱い (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
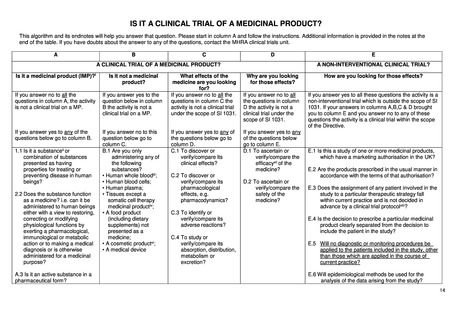
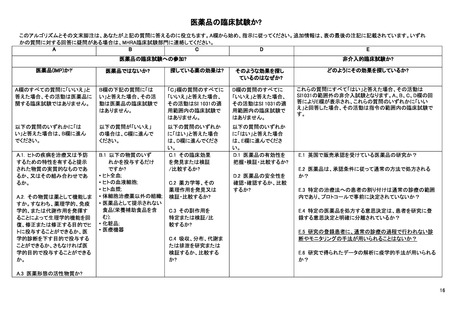
1.
米国
1) コモン・ルール
米国における臨床研究のルールとしては、連邦助成を受けた人を対象とする研究に対する被験者保護の規制である「コモ
ン・ルール」と、医薬品の臨床試験に関する法規制である「Investigational New Drug Application(IND 申請)」、医療機器の市販
前許可に対する規制である「FDA 510(k)」が知られている。
被験者保護の規則である「コモン・ルール」はいくつかの適用除外が存在するものの、基本的には介入の有無によらず、連
邦助成を受ける人を対象とするすべての研究に適用される。すなわち非介入研究であってもコモン・ルールの適用を受ける。
コモン・ルール(Title 45 of the Code of Federal Regulations, Part46, 45 CFR 46)
原文
日本語訳
Except as detailed in § 46.104, this policy applies to all §46.104 に詳述されている場合を除き、本方針は、本方針
research involving human subjects conducted, supported, or を当該研究に適用するために適切な行政措置を講じた連邦
otherwise subject to regulation by any Federal department or 省庁が実施、支援、またはその他の形で規制の対象とす
agency that takes appropriate administrative action to make る、人間を対象とするすべての研究に適用される。これに
the policy applicable to such research. This includes research は、連邦の文民職員または軍人によって行われる研究が
conducted by Federal civilian employees or military personnel, 含まれる。ただし、各部局または機関の長は、管理上適切
except that each department or agency head may adopt such と思われる手続き上の変更を採用することができる。また、
procedural modifications as may be appropriate from an 米国外で連邦政府が実施、支援、またはその他の形で規制
administrative standpoint. It also includes research conducted, の対象となる研究も含まれる。この段落に記載された研究
supported, or otherwise subject to regulation by the Federal に従事する機関、およびこのポリシーの対象となる研究を
Government outside the United States. Institutions that are 審査する機関審査委員会(IRB)は、このポリシーを遵守しな
engaged in research described in this paragraph and ければならない。
institutional review boards (IRBs) reviewing research that is
subject to this policy must comply with this policy.
2) 医薬品に関する規制
新薬(new drug)を用いた臨床試験を行う場合には連邦食品医薬品化粧品法(Federal Food, Drug, and Cosmetic Act, FDC 法)
に基づき研究用新薬申請(IND application)を行う必要がある。FDA による規制はコモン・ルールの適用外となっているが、コ
モン・ルールで規定されている被験者保護の原則はほぼ取り入れられる努力がなされている。
IND 申請の適用範囲としては研究用に医薬品を用いる場合であるが、添付文書や広告内容の変更を要さず、被験者のリス
クを著しく増加させない場合などの一定の条件を満たす場合には IND 申請が免除されており、特に市販薬を用いた臨床試験
の場合には適用されないケースも多い。ここで、商業的目的の有無と、リスクの程度によって適用を変える点は、日本におけ
る特定臨床研究の該当性と類似していると言える。
IND 申請は研究用の医薬品の使用が起点になっており、日常診療どおりに医薬品が用いられる場合には、研究の中で検査
の上乗せがある場合であっても対象外である。
Title 21 Code of Federal Regulations Part 312 (21 CFR 312)
原文
§ 312.2 Applicability.
(a) Applicability. Except as provided in this section, this part
applies to all clinical investigations of products that are subject
to section 505 of the Federal Food, Drug, and Cosmetic Act or
to the licensing provisions of the Public Health Service Act (58
Stat. 632, as amended (42 U.S.C. 201 et seq.)).
§ 312.2 適用
(a) 適用。 本節で規定されている場合を除き、本パートは、
連邦食品医薬品化粧品法第 505 条または公衆衛生サービ
ス法(58 Stat.632, as amended (42 U.S.C. 201 et seq))のライ
センス条項の対象となる医薬品のすべての臨床試験に適
用される。
(b) Exemptions.
(1) The clinical investigation of a drug product that is lawfully
marketed in the United States is exempt from the
requirements of this part if all the following apply:
(i) The investigation is not intended to be reported to FDA
b) 免除。
(1) 米国で合法的に販売されている医薬品の臨床試験が、
以下のすべてに該当する場合、本編の要件から免除され
る。
(i) 研究が新しい使用目的の裏付けとなる十分に管理さ
日本語訳
2
米国
1) コモン・ルール
米国における臨床研究のルールとしては、連邦助成を受けた人を対象とする研究に対する被験者保護の規制である「コモ
ン・ルール」と、医薬品の臨床試験に関する法規制である「Investigational New Drug Application(IND 申請)」、医療機器の市販
前許可に対する規制である「FDA 510(k)」が知られている。
被験者保護の規則である「コモン・ルール」はいくつかの適用除外が存在するものの、基本的には介入の有無によらず、連
邦助成を受ける人を対象とするすべての研究に適用される。すなわち非介入研究であってもコモン・ルールの適用を受ける。
コモン・ルール(Title 45 of the Code of Federal Regulations, Part46, 45 CFR 46)
原文
日本語訳
Except as detailed in § 46.104, this policy applies to all §46.104 に詳述されている場合を除き、本方針は、本方針
research involving human subjects conducted, supported, or を当該研究に適用するために適切な行政措置を講じた連邦
otherwise subject to regulation by any Federal department or 省庁が実施、支援、またはその他の形で規制の対象とす
agency that takes appropriate administrative action to make る、人間を対象とするすべての研究に適用される。これに
the policy applicable to such research. This includes research は、連邦の文民職員または軍人によって行われる研究が
conducted by Federal civilian employees or military personnel, 含まれる。ただし、各部局または機関の長は、管理上適切
except that each department or agency head may adopt such と思われる手続き上の変更を採用することができる。また、
procedural modifications as may be appropriate from an 米国外で連邦政府が実施、支援、またはその他の形で規制
administrative standpoint. It also includes research conducted, の対象となる研究も含まれる。この段落に記載された研究
supported, or otherwise subject to regulation by the Federal に従事する機関、およびこのポリシーの対象となる研究を
Government outside the United States. Institutions that are 審査する機関審査委員会(IRB)は、このポリシーを遵守しな
engaged in research described in this paragraph and ければならない。
institutional review boards (IRBs) reviewing research that is
subject to this policy must comply with this policy.
2) 医薬品に関する規制
新薬(new drug)を用いた臨床試験を行う場合には連邦食品医薬品化粧品法(Federal Food, Drug, and Cosmetic Act, FDC 法)
に基づき研究用新薬申請(IND application)を行う必要がある。FDA による規制はコモン・ルールの適用外となっているが、コ
モン・ルールで規定されている被験者保護の原則はほぼ取り入れられる努力がなされている。
IND 申請の適用範囲としては研究用に医薬品を用いる場合であるが、添付文書や広告内容の変更を要さず、被験者のリス
クを著しく増加させない場合などの一定の条件を満たす場合には IND 申請が免除されており、特に市販薬を用いた臨床試験
の場合には適用されないケースも多い。ここで、商業的目的の有無と、リスクの程度によって適用を変える点は、日本におけ
る特定臨床研究の該当性と類似していると言える。
IND 申請は研究用の医薬品の使用が起点になっており、日常診療どおりに医薬品が用いられる場合には、研究の中で検査
の上乗せがある場合であっても対象外である。
Title 21 Code of Federal Regulations Part 312 (21 CFR 312)
原文
§ 312.2 Applicability.
(a) Applicability. Except as provided in this section, this part
applies to all clinical investigations of products that are subject
to section 505 of the Federal Food, Drug, and Cosmetic Act or
to the licensing provisions of the Public Health Service Act (58
Stat. 632, as amended (42 U.S.C. 201 et seq.)).
§ 312.2 適用
(a) 適用。 本節で規定されている場合を除き、本パートは、
連邦食品医薬品化粧品法第 505 条または公衆衛生サービ
ス法(58 Stat.632, as amended (42 U.S.C. 201 et seq))のライ
センス条項の対象となる医薬品のすべての臨床試験に適
用される。
(b) Exemptions.
(1) The clinical investigation of a drug product that is lawfully
marketed in the United States is exempt from the
requirements of this part if all the following apply:
(i) The investigation is not intended to be reported to FDA
b) 免除。
(1) 米国で合法的に販売されている医薬品の臨床試験が、
以下のすべてに該当する場合、本編の要件から免除され
る。
(i) 研究が新しい使用目的の裏付けとなる十分に管理さ
日本語訳
2