よむ、つかう、まなぶ。
参考資料1-2: 令和3年度厚生労働科学特別研究事業「臨床研究法の見直しの審議における新たな課題・論点への対応策の確立のための研究」班 欧米での観察研究の取り扱い (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2) 医療機器に関する規制
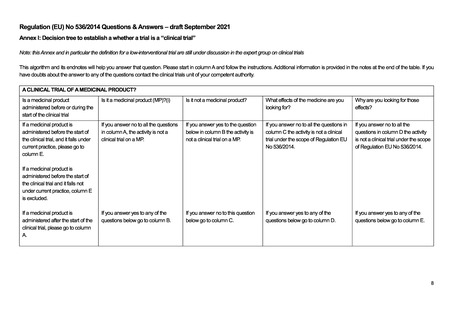
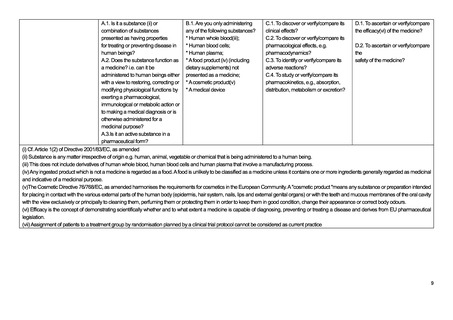
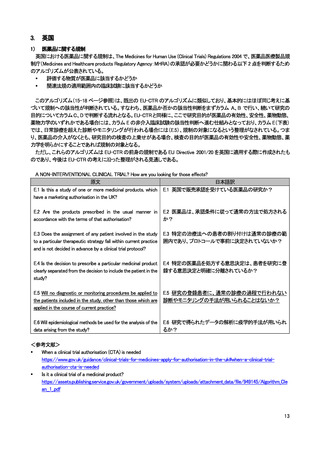
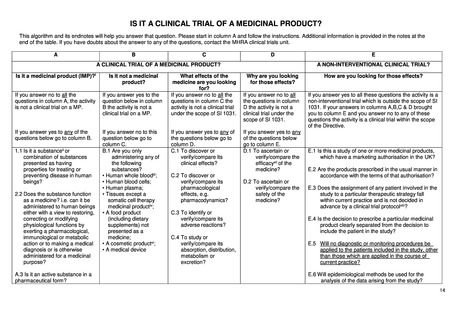
英国における医療機器に関する規制は、UK Medical Device Regulations 2002 を通じて、以下の 3 つの指令が適用されてい
る。2021 年以降に発効する新たな EU regulations on medical devices は英国に対して直接適用されるわけではないが、英国に
おける医療機器規制についても引き続き国際基準への調和がなされる方針とされている。
Directive 90/385/EEC on active implantable medical devices (EU AIMDD)
Directive 93/42/EEC on medical devices (EU MDD)
Directive 98/79/EC on in vitro diagnostic medical devices (EU IVDD)
Guidance. Regulating medical devices in the UK.
https://www.gov.uk/guidance/regulating-medical-devices-in-the-uk
18
英国における医療機器に関する規制は、UK Medical Device Regulations 2002 を通じて、以下の 3 つの指令が適用されてい
る。2021 年以降に発効する新たな EU regulations on medical devices は英国に対して直接適用されるわけではないが、英国に
おける医療機器規制についても引き続き国際基準への調和がなされる方針とされている。
Directive 90/385/EEC on active implantable medical devices (EU AIMDD)
Directive 93/42/EEC on medical devices (EU MDD)
Directive 98/79/EC on in vitro diagnostic medical devices (EU IVDD)
Guidance. Regulating medical devices in the UK.
https://www.gov.uk/guidance/regulating-medical-devices-in-the-uk
18