よむ、つかう、まなぶ。
参考資料1-2: 令和3年度厚生労働科学特別研究事業「臨床研究法の見直しの審議における新たな課題・論点への対応策の確立のための研究」班 欧米での観察研究の取り扱い (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
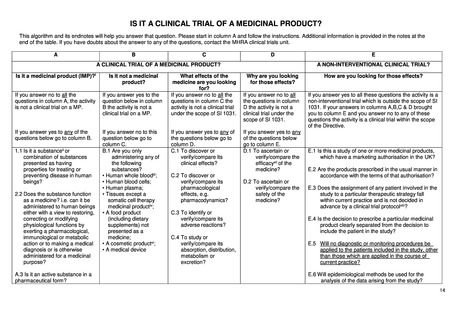
EU 規制 No 536/2014 Questions & Answers-2021 年 9 月草案
付表 I:臨床試験が「臨床試験」であるか否かを確定するためのディシジョンツリー
注:本付表および特に低介入試験の定義については、臨床試験に関する専門家グループにおいて依然として議論中である
このアルゴリズムとその文末脚注は、あなたが冒頭の質問に答えるのに役立ちます。A 欄から始め、指示に従ってください。追加情報は、表の最後の注記に記載されています。いずれかの質問に対
する回答に疑問がある場合は、担当規制当局の臨床試験部署に連絡してください。
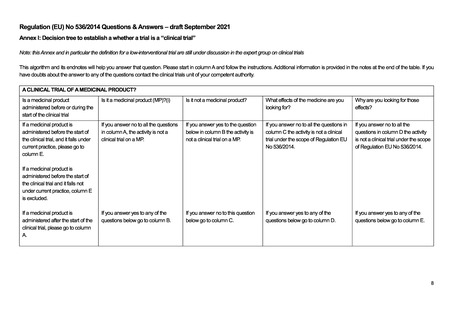
医薬品の臨床試験であるか否か?
臨床試験開始前又は臨床試験開
医薬品(MP)か?(i)
医薬品ではないか。
あなたが探している薬の効果は?
そのような効果を探しているのはな
始中に投与される医薬品であるか
ぜか。
臨床試験開始前に医薬品が投与さ A 欄のすべての質問に「いいえ」と答 B 欄の下記の質問に「はい」と答え C 欄のすべての質問に「いいえ」と答え D 欄に記載されているすべての質
れており、現行の診療の範囲内で
えた場合、その活動は医薬品に関す た場合、その活動は医薬品上の臨 た場合、EU 規制 No 536/2014 の適用
問への回答が「いいえ」の場合、そ
ある場合は、E 欄へ進んでくださ
る臨床試験ではありません。
床試験ではありません。
を受ける臨床試験ではありません。
の活動は EU 規制 No 536/2014 の
い。
適用範囲内の臨床試験ではありま
臨床試験開始前に医薬品が投与さ
せん。
れ、現行の診療に該当しない場合
は、E 欄は当てはまりません。
以下の質問のいずれかに「はい」と
臨床試験開始後に医薬品を投与す 以下の質問のいずれかに「はい」と答 以下の質問への答えが「いいえ」の 以下の質問のいずれかに「はい」と答え 答えた場合は、E 欄に進んでくださ
る場合は、A 欄へ進んでください。 えた場合は、B 欄に進んでください。
場合は、C 欄に進んでください。
た場合は、D 欄に進んでください。
い。
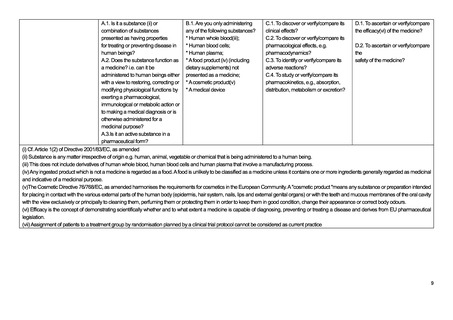
A.1. 人の疾病を治療又は予防するた B.1.以下の物質のいずれかを投与
C.1.その臨床効果を発見または検証/比 D.1.医薬品の有効性(vi)を確認又は
めの特性を有すると提示された物質
するだけか?
較するためか?
比較するか?
(ii)又は物質の組み合わせか?
* ヒト全血(iii);
* ヒトの血液細胞;
C.2.薬力学等、その薬理作用を発見又は D.2. 薬の安全性を確認または検証/
A.2. その物質は薬として機能するか? * ヒト血漿;
検証・比較するか?
比較するか?
すなわち、薬理学的、免疫学的、また * 医薬品として提示されない食品
は代謝作用を発揮することによって生 (iv) (栄養補助食品を含む);
C.3.その副作用を特定または検証/比較
理学的機能を回復、修正または修正
* 化粧品(v)
するか?
する目的でヒトに投与するか、医学的 * 医療機器
診断を下す目的で投与するか、さもな
C.4.吸収、分布、代謝又は排泄などの薬
ければ医学的目的で投与するか?
物動態を検討又は比較するか?
A.3. 医薬品としての有効成分か?
10
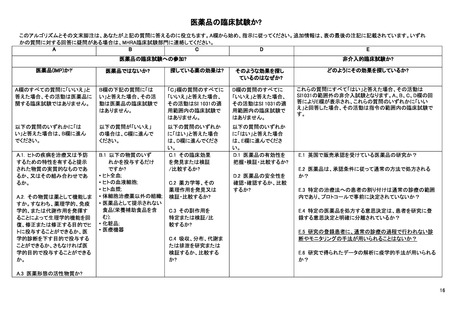
付表 I:臨床試験が「臨床試験」であるか否かを確定するためのディシジョンツリー
注:本付表および特に低介入試験の定義については、臨床試験に関する専門家グループにおいて依然として議論中である
このアルゴリズムとその文末脚注は、あなたが冒頭の質問に答えるのに役立ちます。A 欄から始め、指示に従ってください。追加情報は、表の最後の注記に記載されています。いずれかの質問に対
する回答に疑問がある場合は、担当規制当局の臨床試験部署に連絡してください。
医薬品の臨床試験であるか否か?
臨床試験開始前又は臨床試験開
医薬品(MP)か?(i)
医薬品ではないか。
あなたが探している薬の効果は?
そのような効果を探しているのはな
始中に投与される医薬品であるか
ぜか。
臨床試験開始前に医薬品が投与さ A 欄のすべての質問に「いいえ」と答 B 欄の下記の質問に「はい」と答え C 欄のすべての質問に「いいえ」と答え D 欄に記載されているすべての質
れており、現行の診療の範囲内で
えた場合、その活動は医薬品に関す た場合、その活動は医薬品上の臨 た場合、EU 規制 No 536/2014 の適用
問への回答が「いいえ」の場合、そ
ある場合は、E 欄へ進んでくださ
る臨床試験ではありません。
床試験ではありません。
を受ける臨床試験ではありません。
の活動は EU 規制 No 536/2014 の
い。
適用範囲内の臨床試験ではありま
臨床試験開始前に医薬品が投与さ
せん。
れ、現行の診療に該当しない場合
は、E 欄は当てはまりません。
以下の質問のいずれかに「はい」と
臨床試験開始後に医薬品を投与す 以下の質問のいずれかに「はい」と答 以下の質問への答えが「いいえ」の 以下の質問のいずれかに「はい」と答え 答えた場合は、E 欄に進んでくださ
る場合は、A 欄へ進んでください。 えた場合は、B 欄に進んでください。
場合は、C 欄に進んでください。
た場合は、D 欄に進んでください。
い。
A.1. 人の疾病を治療又は予防するた B.1.以下の物質のいずれかを投与
C.1.その臨床効果を発見または検証/比 D.1.医薬品の有効性(vi)を確認又は
めの特性を有すると提示された物質
するだけか?
較するためか?
比較するか?
(ii)又は物質の組み合わせか?
* ヒト全血(iii);
* ヒトの血液細胞;
C.2.薬力学等、その薬理作用を発見又は D.2. 薬の安全性を確認または検証/
A.2. その物質は薬として機能するか? * ヒト血漿;
検証・比較するか?
比較するか?
すなわち、薬理学的、免疫学的、また * 医薬品として提示されない食品
は代謝作用を発揮することによって生 (iv) (栄養補助食品を含む);
C.3.その副作用を特定または検証/比較
理学的機能を回復、修正または修正
* 化粧品(v)
するか?
する目的でヒトに投与するか、医学的 * 医療機器
診断を下す目的で投与するか、さもな
C.4.吸収、分布、代謝又は排泄などの薬
ければ医学的目的で投与するか?
物動態を検討又は比較するか?
A.3. 医薬品としての有効成分か?
10