よむ、つかう、まなぶ。
参考資料1-2: 令和3年度厚生労働科学特別研究事業「臨床研究法の見直しの審議における新たな課題・論点への対応策の確立のための研究」班 欧米での観察研究の取り扱い (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.
英国
1) 医薬品に関する規制
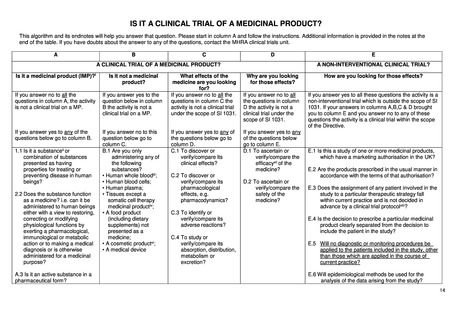
英国における医薬品に関する規制は、The Medicines for Human Use (Clinical Trials) Regulations 2004 で、医薬品医療製品規
制庁(Medicines and Healthcare products Regulatory Agency:MHRA)の承認が必要かどうかに関わる以下 2 点を判断するため
のアルゴリズムが公表されている。
評価する物質が医薬品に該当するかどうか
関連法規の適用範囲内の臨床試験に該当するかどうか
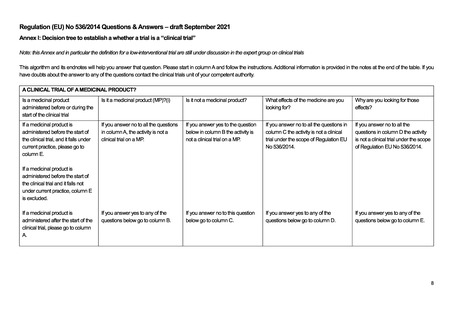
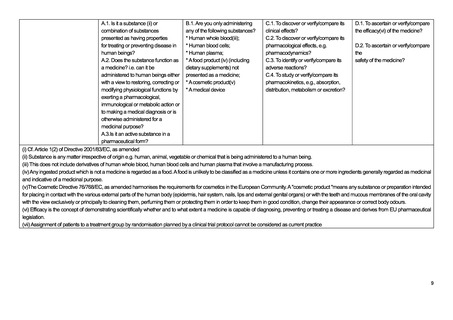
このアルゴリズム(15-18 ページ参照)は、既出の EU-CTR のアルゴリズムに類似しており、基本的にはほぼ同じ考えに基
づいて規制への該当性が判断されている。すなわち、医薬品か否かの該当性判断をまずカラム A、B で行い、続いて研究の
目的についてカラム C、D で判断する流れとなる。EU-CTR と同様に、ここで研究目的が医薬品の有効性、安全性、薬物動態、
薬物力学のいずれかである場合には、カラム E の非介入臨床試験の該当性判断へ進む仕組みとなっており、カラム E(下表)
では、日常診療を超えた診断やモニタリングが行われる場合には(E.5)、規制の対象になるという整理がなされている。つま
り、医薬品の介入がなくとも、研究目的の検査の上乗せがある場合、検査の目的が医薬品の有効性や安全性、薬物動態、薬
力学を明らかにすることであれば規制の対象となる。
ただし、これらのアルゴリズムは EU-CTR の前身の規制である EU Directive 2001/20 を英国に適用する際に作成されたも
のであり、今後は EU-CTR の考えに沿った整理がされる見通しである。
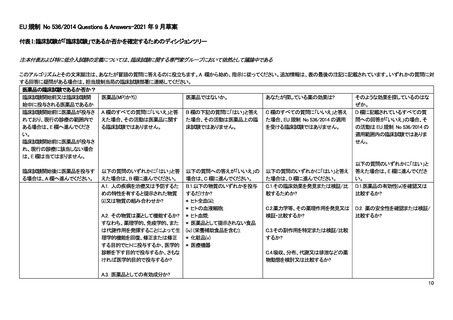
A NON-INTERVENTIONAL CLINICAL TRIAL? How are you looking for those effects?
原文
日本語訳
E.1 Is this a study of one or more medicinal products, which E.1 英国で販売承認を受けている医薬品の研究か?
have a marketing authorisation in the UK?
E.2 Are the products prescribed in the usual manner in
accordance with the terms of that authorisation?
E.2 医薬品は、承認条件に従って通常の方法で処方される
か?
E.3 Does the assignment of any patient involved in the study
to a particular therapeutic strategy fall within current practice
and is not decided in advance by a clinical trial protocol?
E.3 特定の治療法への患者の割り付けは通常の診療の範
囲内であり、プロトコールで事前に決定されていないか?
E.4 Is the decision to prescribe a particular medicinal product
clearly separated from the decision to include the patient in the
study?
E.4 特定の医薬品を処方する意思決定は、患者を研究に登
録する意思決定と明確に分離されているか?
E.5 Will no diagnostic or monitoring procedures be applied to
the patients included in the study, other than those which are
applied in the course of current practice?
E.5 研究の登録患者に、通常の診療の過程で行われない
診断やモニタリングの手法が用いられることはないか?
E.6 Will epidemiological methods be used for the analysis of the
data arising from the study?
E.6 研究で得られたデータの解析に疫学的手法が用いられ
るか?
<参考文献>
When a clinical trial authorisation (CTA) is needed
https://www.gov.uk/guidance/clinical-trials-for-medicines-apply-for-authorisation-in-the-uk#when-a-clinical-trialauthorisation-cta-is-needed
Is it a clinical trial of a medicinal product?
https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/949145/Algorithm_Cle
an__1_.pdf
13
英国
1) 医薬品に関する規制
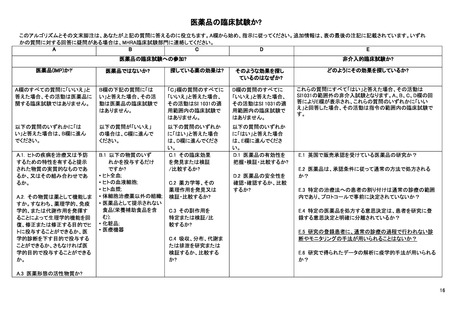
英国における医薬品に関する規制は、The Medicines for Human Use (Clinical Trials) Regulations 2004 で、医薬品医療製品規
制庁(Medicines and Healthcare products Regulatory Agency:MHRA)の承認が必要かどうかに関わる以下 2 点を判断するため
のアルゴリズムが公表されている。
評価する物質が医薬品に該当するかどうか
関連法規の適用範囲内の臨床試験に該当するかどうか
このアルゴリズム(15-18 ページ参照)は、既出の EU-CTR のアルゴリズムに類似しており、基本的にはほぼ同じ考えに基
づいて規制への該当性が判断されている。すなわち、医薬品か否かの該当性判断をまずカラム A、B で行い、続いて研究の
目的についてカラム C、D で判断する流れとなる。EU-CTR と同様に、ここで研究目的が医薬品の有効性、安全性、薬物動態、
薬物力学のいずれかである場合には、カラム E の非介入臨床試験の該当性判断へ進む仕組みとなっており、カラム E(下表)
では、日常診療を超えた診断やモニタリングが行われる場合には(E.5)、規制の対象になるという整理がなされている。つま
り、医薬品の介入がなくとも、研究目的の検査の上乗せがある場合、検査の目的が医薬品の有効性や安全性、薬物動態、薬
力学を明らかにすることであれば規制の対象となる。
ただし、これらのアルゴリズムは EU-CTR の前身の規制である EU Directive 2001/20 を英国に適用する際に作成されたも
のであり、今後は EU-CTR の考えに沿った整理がされる見通しである。
A NON-INTERVENTIONAL CLINICAL TRIAL? How are you looking for those effects?
原文
日本語訳
E.1 Is this a study of one or more medicinal products, which E.1 英国で販売承認を受けている医薬品の研究か?
have a marketing authorisation in the UK?
E.2 Are the products prescribed in the usual manner in
accordance with the terms of that authorisation?
E.2 医薬品は、承認条件に従って通常の方法で処方される
か?
E.3 Does the assignment of any patient involved in the study
to a particular therapeutic strategy fall within current practice
and is not decided in advance by a clinical trial protocol?
E.3 特定の治療法への患者の割り付けは通常の診療の範
囲内であり、プロトコールで事前に決定されていないか?
E.4 Is the decision to prescribe a particular medicinal product
clearly separated from the decision to include the patient in the
study?
E.4 特定の医薬品を処方する意思決定は、患者を研究に登
録する意思決定と明確に分離されているか?
E.5 Will no diagnostic or monitoring procedures be applied to
the patients included in the study, other than those which are
applied in the course of current practice?
E.5 研究の登録患者に、通常の診療の過程で行われない
診断やモニタリングの手法が用いられることはないか?
E.6 Will epidemiological methods be used for the analysis of the
data arising from the study?
E.6 研究で得られたデータの解析に疫学的手法が用いられ
るか?
<参考文献>
When a clinical trial authorisation (CTA) is needed
https://www.gov.uk/guidance/clinical-trials-for-medicines-apply-for-authorisation-in-the-uk#when-a-clinical-trialauthorisation-cta-is-needed
Is it a clinical trial of a medicinal product?
https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/949145/Algorithm_Cle
an__1_.pdf
13