よむ、つかう、まなぶ。
資料1:臨床研究法の見直しに係る各論点について (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
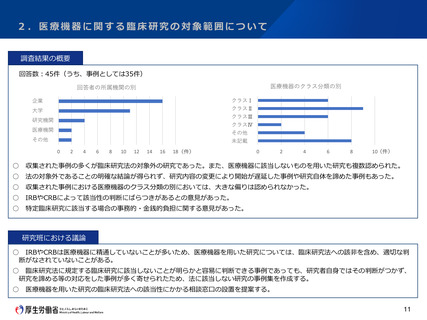
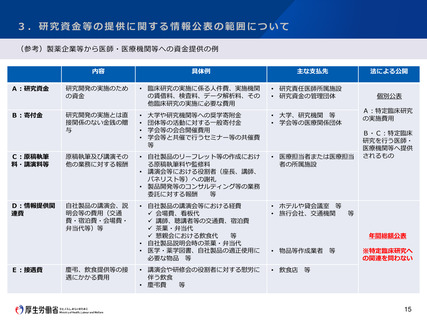
2.医療機器に関する臨床研究の対象範囲について
課題と今後の方針案
○ 「臨床研究法施行5年後の見直しに係る検討の中間とりまとめ」(令和3年12月13日)において、以下のように整理されたところ。
中間とりまとめ
① 現状と課題
○ 医療機器については、医薬品と異なり非侵襲・低侵襲なものが存在するが、これらを特定臨床研究の対象とするのは過剰な規
制ではないかとの指摘がある。
○ 薬機法や医療機器規制国際整合化会合(GHTF)においては、リスクに応じたクラス分類に基づき規制の内容を変えており、臨
床研究法においても、医療機器毎のリスクに基づき取り扱うべきではないかとの指摘がある。
○ 一方で、薬機法上、医療機器については使用方法等を特定し、適正な使用目的に従い適正に使用されることを前提に承認等
を受けており、その前提に基づき、一般医療機器、管理医療機器、高度管理医療機器のいずれに該当するかが判断されている。
○ 既存の製品の改善・改良を臨床現場で評価する場合も、未承認医療機器として特定臨床研究に該当すると判断されると、手
続の負担や資金の観点から実施が困難となる場合があるとの指摘がある。
○ 工学系研究者に対する特定臨床研究の範囲等に関するルールの周知が不十分なため、本来は該当しないものまで特定臨床研
究とされているのではないかとの指摘がある。
②
これまでの主な議論
○ 欧州では、医療機器は臨床試験を規制する法律の対象外であり、医療機器の臨床試験の規制について国際整合性を考えるべ
きであるとの意見があった。
③
今後の対応の方向性
○ 薬機法における各規制区分への該当性については、適正な使用目的に従い適正に使用されることを前提として分類されてお
り、その範囲から逸脱して適応外使用する場合においても、不変的に同じ規制区分に分類されるわけではない。
○ 適応外の医療機器の臨床研究において、当該医療機器が既に許認可を受けた際に分類されたリスク分類と同程度のリスクと
みなせる場合について、医療機器の多様性も考慮し、研究の実態等を調査した上で、当該調査結果に基づき引き続き方策を検討
すべきである。
○ 医療機器を用いた臨床研究に関する実態調査の結果等を踏まえ、今後の対応について、以下の方針としてはどうか。
9
課題と今後の方針案
○ 「臨床研究法施行5年後の見直しに係る検討の中間とりまとめ」(令和3年12月13日)において、以下のように整理されたところ。
中間とりまとめ
① 現状と課題
○ 医療機器については、医薬品と異なり非侵襲・低侵襲なものが存在するが、これらを特定臨床研究の対象とするのは過剰な規
制ではないかとの指摘がある。
○ 薬機法や医療機器規制国際整合化会合(GHTF)においては、リスクに応じたクラス分類に基づき規制の内容を変えており、臨
床研究法においても、医療機器毎のリスクに基づき取り扱うべきではないかとの指摘がある。
○ 一方で、薬機法上、医療機器については使用方法等を特定し、適正な使用目的に従い適正に使用されることを前提に承認等
を受けており、その前提に基づき、一般医療機器、管理医療機器、高度管理医療機器のいずれに該当するかが判断されている。
○ 既存の製品の改善・改良を臨床現場で評価する場合も、未承認医療機器として特定臨床研究に該当すると判断されると、手
続の負担や資金の観点から実施が困難となる場合があるとの指摘がある。
○ 工学系研究者に対する特定臨床研究の範囲等に関するルールの周知が不十分なため、本来は該当しないものまで特定臨床研
究とされているのではないかとの指摘がある。
②
これまでの主な議論
○ 欧州では、医療機器は臨床試験を規制する法律の対象外であり、医療機器の臨床試験の規制について国際整合性を考えるべ
きであるとの意見があった。
③
今後の対応の方向性
○ 薬機法における各規制区分への該当性については、適正な使用目的に従い適正に使用されることを前提として分類されてお
り、その範囲から逸脱して適応外使用する場合においても、不変的に同じ規制区分に分類されるわけではない。
○ 適応外の医療機器の臨床研究において、当該医療機器が既に許認可を受けた際に分類されたリスク分類と同程度のリスクと
みなせる場合について、医療機器の多様性も考慮し、研究の実態等を調査した上で、当該調査結果に基づき引き続き方策を検討
すべきである。
○ 医療機器を用いた臨床研究に関する実態調査の結果等を踏まえ、今後の対応について、以下の方針としてはどうか。
9