よむ、つかう、まなぶ。
資料1:臨床研究法の見直しに係る各論点について (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
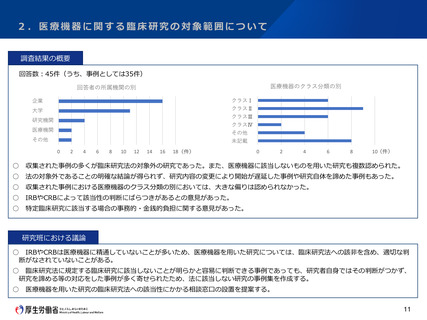
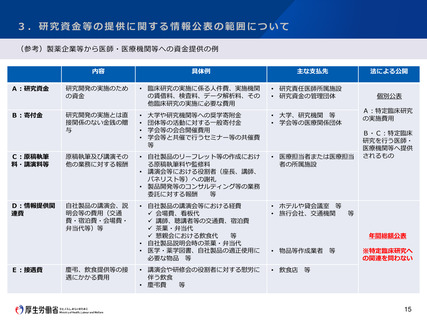
2.医療機器に関する臨床研究の対象範囲について
今後の対応の方向性(案)
医療機器にも共通する対応(中間とりまとめより抜粋)
【 適応外使用に関する特定臨床研究の対象範囲について 】
○ 適応外医薬品等を使用する研究であっても、各種の情報に基づき、そのリスクが承認を受けた用法等と大きく変わらないことが明
らかなものについては、特定臨床研究の範囲から除外する方向で見直しを進めるべきである。
○ この場合、特定臨床研究の範囲から除外するか否かの検討にあたっては、当該医薬品等の使用に係るリスクが承認を受けた用法等
と大きく変わらないかどうかについて、根拠となる情報に基づき、厚生労働省が専門家の意見を聴取する方向で制度を構築すべきで
ある。
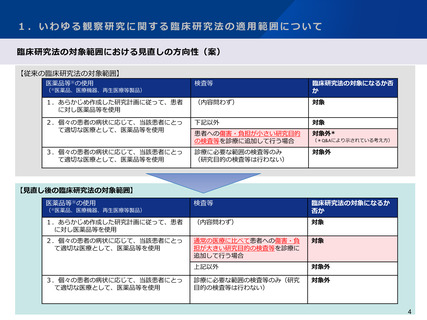
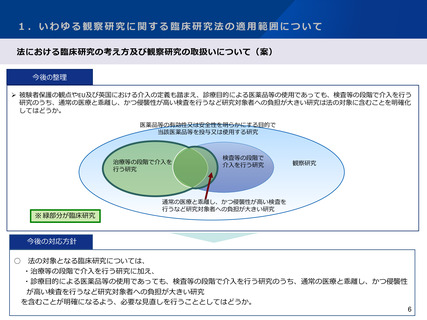
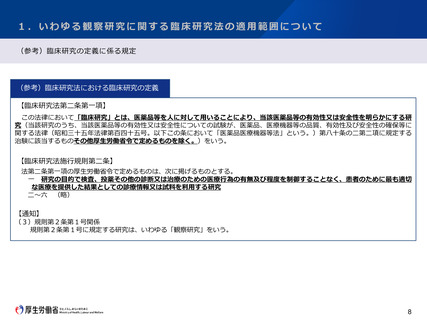
【 いわゆる観察研究に関する臨床研究法の適用範囲について 】
○ 研究対象者の保護の観点に留意し、国際整合性にも配慮しつつ、観察研究の定義と取扱いについて引き続き検討を進めるべきであ
る。
○ 観察研究のうち、研究の目的で行われた検査等について、侵襲が大きい等、研究対象者の身体又は精神に負担が大きい研究以外は、
臨床研究の定義から除外することとすべきである。
○ 臨床研究の定義から除外されない、研究の目的で行われた「侵襲等が大きい等」の検査等については、引き続き情報を収集し、具
体的に例示することで、法への該当性に係る判断の基準やその根拠を明確に示すべきである。
【 認定臨床研究審査委員会について 】
○ CRBの質の向上に向けて、更新要件のみならず、例えば、模擬審査、ピアレビューを実施し、将来的に更新要件への反映を検討す
ることや優良CRBへの支援などの取組を行っていく必要がある。
医療機器特有の取組
○ 厚生労働科学特別研究事業で収集された事例をもとに事例集を作成するとともに、今後も定期的に事例等の収集を行い、随時更新し
ていってはどうか。
○ 関係学会や業界団体の協力を得て、臨床研究法に関するQ&Aや事例集をプッシュ型で周知したり、工学部等の研究者に対して臨床研
究法の考え方を周知する機会を設けてはどうか。
○ 医療機器を用いた研究の臨床研究法への該当性等の相談窓口の設置を進めてはどうか。
12
今後の対応の方向性(案)
医療機器にも共通する対応(中間とりまとめより抜粋)
【 適応外使用に関する特定臨床研究の対象範囲について 】
○ 適応外医薬品等を使用する研究であっても、各種の情報に基づき、そのリスクが承認を受けた用法等と大きく変わらないことが明
らかなものについては、特定臨床研究の範囲から除外する方向で見直しを進めるべきである。
○ この場合、特定臨床研究の範囲から除外するか否かの検討にあたっては、当該医薬品等の使用に係るリスクが承認を受けた用法等
と大きく変わらないかどうかについて、根拠となる情報に基づき、厚生労働省が専門家の意見を聴取する方向で制度を構築すべきで
ある。
【 いわゆる観察研究に関する臨床研究法の適用範囲について 】
○ 研究対象者の保護の観点に留意し、国際整合性にも配慮しつつ、観察研究の定義と取扱いについて引き続き検討を進めるべきであ
る。
○ 観察研究のうち、研究の目的で行われた検査等について、侵襲が大きい等、研究対象者の身体又は精神に負担が大きい研究以外は、
臨床研究の定義から除外することとすべきである。
○ 臨床研究の定義から除外されない、研究の目的で行われた「侵襲等が大きい等」の検査等については、引き続き情報を収集し、具
体的に例示することで、法への該当性に係る判断の基準やその根拠を明確に示すべきである。
【 認定臨床研究審査委員会について 】
○ CRBの質の向上に向けて、更新要件のみならず、例えば、模擬審査、ピアレビューを実施し、将来的に更新要件への反映を検討す
ることや優良CRBへの支援などの取組を行っていく必要がある。
医療機器特有の取組
○ 厚生労働科学特別研究事業で収集された事例をもとに事例集を作成するとともに、今後も定期的に事例等の収集を行い、随時更新し
ていってはどうか。
○ 関係学会や業界団体の協力を得て、臨床研究法に関するQ&Aや事例集をプッシュ型で周知したり、工学部等の研究者に対して臨床研
究法の考え方を周知する機会を設けてはどうか。
○ 医療機器を用いた研究の臨床研究法への該当性等の相談窓口の設置を進めてはどうか。
12