よむ、つかう、まなぶ。
資料1:臨床研究法の見直しに係る各論点について (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.医療機器に関する臨床研究の対象範囲について
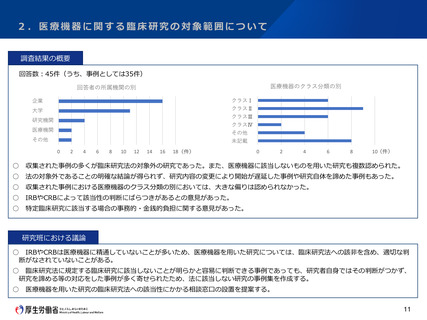
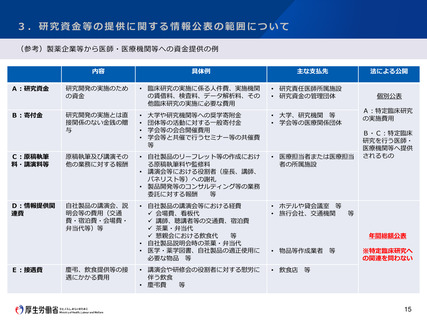
調査結果の概要
回答数:45件(うち、事例としては35件)
医療機器のクラス分類の別
回答者の所属機関の別
企業
クラスⅠ
大学
クラスⅡ
クラスⅢ
研究機関
クラスⅣ
医療機関
その他
その他
未記載
0
2
4
6
8
10
12
14
16
18(件)
0
2
4
6
8
10(件)
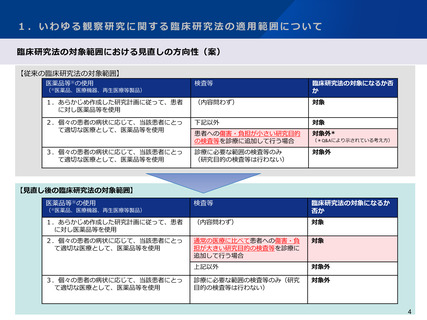
○ 収集された事例の多くが臨床研究法の対象外の研究であった。また、医療機器に該当しないものを用いた研究も複数認められた。
○ 法の対象外であることの明確な結論が得られず、研究内容の変更により開始が遅延した事例や研究自体を諦めた事例もあった。
○ 収集された事例における医療機器のクラス分類の別においては、大きな偏りは認められなかった。
○ IRBやCRBによって該当性の判断にばらつきがあるとの意見があった。
○ 特定臨床研究に該当する場合の事務的・金銭的負担に関する意見があった。
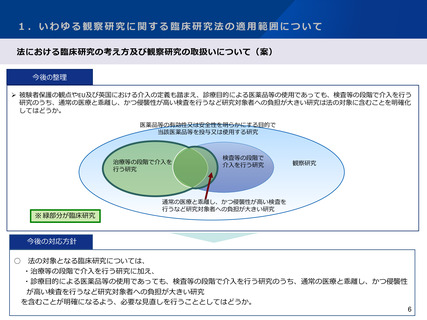
研究班における議論
○ IRBやCRBは医療機器に精通していないことが多いため、医療機器を用いた研究については、臨床研究法への該非を含め、適切な判
断がなされていないことがある。
○ 臨床研究法に規定する臨床研究に該当しないことが明らかと容易に判断できる事例であっても、研究者自身ではその判断がつかず、
研究を諦める等の対応をした事例が多く寄せられたため、法に該当しない研究の事例集を作成する。
○ 医療機器を用いた研究の臨床研究法への該当性にかかる相談窓口の設置を提案する。
11
調査結果の概要
回答数:45件(うち、事例としては35件)
医療機器のクラス分類の別
回答者の所属機関の別
企業
クラスⅠ
大学
クラスⅡ
クラスⅢ
研究機関
クラスⅣ
医療機関
その他
その他
未記載
0
2
4
6
8
10
12
14
16
18(件)
0
2
4
6
8
10(件)
○ 収集された事例の多くが臨床研究法の対象外の研究であった。また、医療機器に該当しないものを用いた研究も複数認められた。
○ 法の対象外であることの明確な結論が得られず、研究内容の変更により開始が遅延した事例や研究自体を諦めた事例もあった。
○ 収集された事例における医療機器のクラス分類の別においては、大きな偏りは認められなかった。
○ IRBやCRBによって該当性の判断にばらつきがあるとの意見があった。
○ 特定臨床研究に該当する場合の事務的・金銭的負担に関する意見があった。
研究班における議論
○ IRBやCRBは医療機器に精通していないことが多いため、医療機器を用いた研究については、臨床研究法への該非を含め、適切な判
断がなされていないことがある。
○ 臨床研究法に規定する臨床研究に該当しないことが明らかと容易に判断できる事例であっても、研究者自身ではその判断がつかず、
研究を諦める等の対応をした事例が多く寄せられたため、法に該当しない研究の事例集を作成する。
○ 医療機器を用いた研究の臨床研究法への該当性にかかる相談窓口の設置を提案する。
11