よむ、つかう、まなぶ。
資料1:臨床研究法の見直しに係る各論点について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
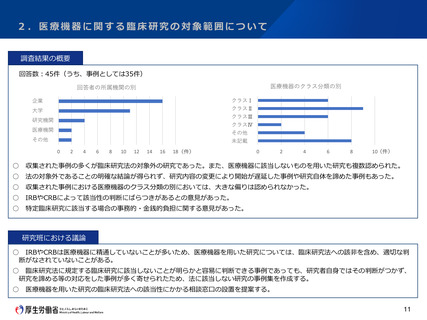
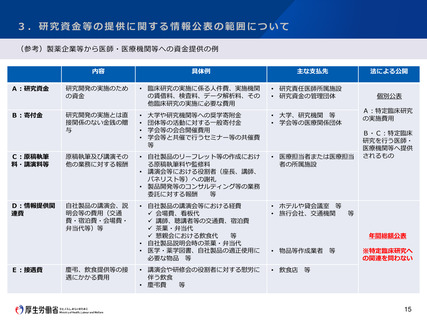
2.医療機器に関する臨床研究の対象範囲について
特別研究班による調査
<参考> 令和3年度厚生労働科学特別研究事業
研究課題名 : 臨床研究法が医療機器開発研究に与えた影響の実態把握に向けた調査研究
研究代表者 : 京都大学 黒田 知宏(日本生体医工学会 理事)
研究内容
生体医工学会に所属する工学系研究者(1300人程度)及び製造販売業者等の医療機器開発に関わる企業(4000社程
度)を対象としたアンケート調査を実施し、調査対象者が臨床研究法への該当性判断に迷った事例を収集する。
最終的には、集積した事例を特定臨床研究に該当する事例、特定臨床研究以外の臨床研究に該当する事例、臨床研究
に該当しない事例に分類し、事例集として公表することを目指す。
< 調査期間 >
2021年11月1日 ~ 2021年11月30日(1ヶ月)
< 調査対象 >
生体医工学会を含む関係学会に所属する研究者、医機連に属する企業
< 調査方法 >
インターネットによるアンケート調査
(本調査の特設ページを医機連のHPに作成し、個別の関係学会等及び医機連関係企業に対して周知のメールを送付した)
< 調査項目 >
研究タイトル、該当機器の名前、該当機器の効果、該当機器のクラス分類、実施しようとした研究、
臨床研究への該当性に迷った理由、自らが下した該当性判断とその根拠、指摘を受けた場合はその指摘内容、指摘元
等
10
特別研究班による調査
<参考> 令和3年度厚生労働科学特別研究事業
研究課題名 : 臨床研究法が医療機器開発研究に与えた影響の実態把握に向けた調査研究
研究代表者 : 京都大学 黒田 知宏(日本生体医工学会 理事)
研究内容
生体医工学会に所属する工学系研究者(1300人程度)及び製造販売業者等の医療機器開発に関わる企業(4000社程
度)を対象としたアンケート調査を実施し、調査対象者が臨床研究法への該当性判断に迷った事例を収集する。
最終的には、集積した事例を特定臨床研究に該当する事例、特定臨床研究以外の臨床研究に該当する事例、臨床研究
に該当しない事例に分類し、事例集として公表することを目指す。
< 調査期間 >
2021年11月1日 ~ 2021年11月30日(1ヶ月)
< 調査対象 >
生体医工学会を含む関係学会に所属する研究者、医機連に属する企業
< 調査方法 >
インターネットによるアンケート調査
(本調査の特設ページを医機連のHPに作成し、個別の関係学会等及び医機連関係企業に対して周知のメールを送付した)
< 調査項目 >
研究タイトル、該当機器の名前、該当機器の効果、該当機器のクラス分類、実施しようとした研究、
臨床研究への該当性に迷った理由、自らが下した該当性判断とその根拠、指摘を受けた場合はその指摘内容、指摘元
等
10