よむ、つかう、まなぶ。
資料1:臨床研究法の見直しに係る各論点について (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
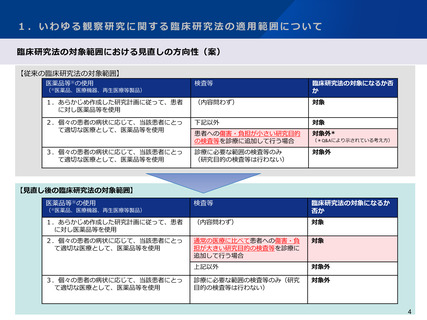
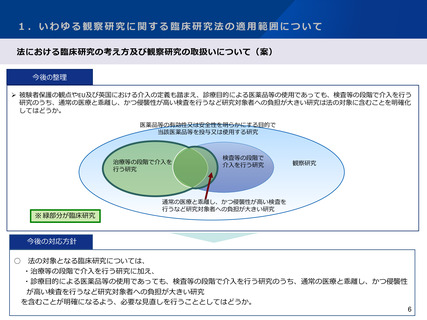
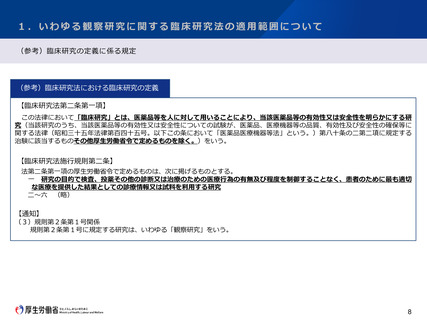
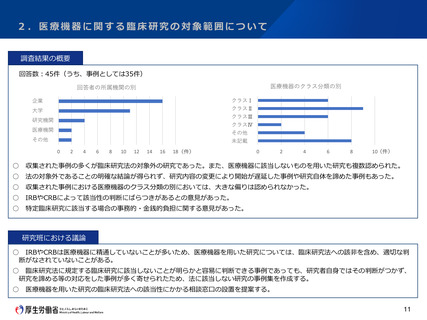
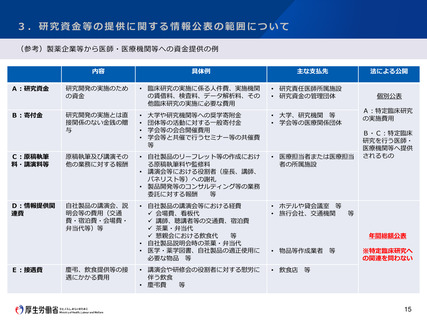
3.研究資金等の提供に関する情報公表の範囲について
今後の対応の方向性(案)
情報提供関連費・接遇費は、既に公表対象となっている研究資金・寄附金等と異なり、医師・医療機関等に対して支払わ
れるものではなく、臨床研究の費用として充てられることは通常想定されないため、臨床研究の不正に繋がる蓋然性は低い
と考えられることから、法制定当初においては、情報公表の対象としないこととしたところ。
これに対して、法制定当時の国会審議においては、情報提供関連費・接遇費を公表対象外とすることによる費目の付け替
えの可能性が指摘され、附帯決議において「学問の自由に配慮しつつ臨床研究の一層の信頼確保を図るため、研究資金等の
提供に関する情報等の公表制度の実施状況を踏まえながら、本法の公表の対象外とされている情報提供関連費や接遇費等を
公表の対象とすることについて検討すること」が求められたところである。
今回、法制定から5年後の見直しを検討するにあたり、製薬協会員企業の透明性ガイドラインに基づく資金提供の公開状
況を見たところ、法施行後に情報提供関連費・接遇費の割合が急増するなどといった状況は見られないが、業界のガイドラ
インに基づく自主的な公開であり、特定臨床研究に関与している全ての企業が公開を行っているものではないため、費目の
付け替えが行われている可能性の有無を確認できる状態にない企業が存在する。
このため、附帯決議における問題意識も踏まえ、特定臨床研究に関与する企業については、更なる透明性の確保を図る観
点から、情報提供関連費・接遇費を公表し、費目の付け替えが行われている可能性の有無を確認できる状態とするよう、法
令で義務付けることとしてはどうか。
その際、情報提供関連費・接遇費については、費用の性質上、それ自体が臨床研究の不正に繋がる蓋然性は低いと考えら
れる中で、企業の実務負担も考慮し、企業における年間総額のみを公表対象とすることとしてはどうか。
14
今後の対応の方向性(案)
情報提供関連費・接遇費は、既に公表対象となっている研究資金・寄附金等と異なり、医師・医療機関等に対して支払わ
れるものではなく、臨床研究の費用として充てられることは通常想定されないため、臨床研究の不正に繋がる蓋然性は低い
と考えられることから、法制定当初においては、情報公表の対象としないこととしたところ。
これに対して、法制定当時の国会審議においては、情報提供関連費・接遇費を公表対象外とすることによる費目の付け替
えの可能性が指摘され、附帯決議において「学問の自由に配慮しつつ臨床研究の一層の信頼確保を図るため、研究資金等の
提供に関する情報等の公表制度の実施状況を踏まえながら、本法の公表の対象外とされている情報提供関連費や接遇費等を
公表の対象とすることについて検討すること」が求められたところである。
今回、法制定から5年後の見直しを検討するにあたり、製薬協会員企業の透明性ガイドラインに基づく資金提供の公開状
況を見たところ、法施行後に情報提供関連費・接遇費の割合が急増するなどといった状況は見られないが、業界のガイドラ
インに基づく自主的な公開であり、特定臨床研究に関与している全ての企業が公開を行っているものではないため、費目の
付け替えが行われている可能性の有無を確認できる状態にない企業が存在する。
このため、附帯決議における問題意識も踏まえ、特定臨床研究に関与する企業については、更なる透明性の確保を図る観
点から、情報提供関連費・接遇費を公表し、費目の付け替えが行われている可能性の有無を確認できる状態とするよう、法
令で義務付けることとしてはどうか。
その際、情報提供関連費・接遇費については、費用の性質上、それ自体が臨床研究の不正に繋がる蓋然性は低いと考えら
れる中で、企業の実務負担も考慮し、企業における年間総額のみを公表対象とすることとしてはどうか。
14