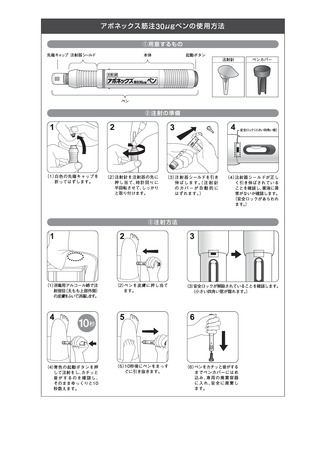
よむ、つかう、まなぶ。
資料2-3 インターフェロンベータ-1a(遺伝子組換え)及びインターフェロンベータ-1b(遺伝子組換え)の電子化された添付文書一覧 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
十分である場合には、血中の中和抗体価を測定し、その
後 の 治 療 継 続 に つ い て 検 討 す る こ と が 推 奨 さ れ る。
[8.7 参照]
15.1.2 がん原性試験は行われていない。
15.1.3 海外で行われた外国人多発性硬化症患者を対象とし
たインターフェロン ベータ-1a製剤とnatalizumab(α4イ
ンテグリン拮抗薬)との併用試験において、 2 例の進行
性多巣性白質脳症(PML)が認められた。この 2 例は、
いずれもnatalizumabとインターフェロン ベータ-1a製剤
(30μg)の併用開始後 2 年以上経過した後にPMLを発症
した2)。このうち 1 例は死亡し3)、他の 1 例は重度障害を
残した4)。
15.1.4 海外で行われた外国人健康成人を対象とした試験に
おいて、インターフェロン ベータ-1a製剤の投与を開始
する際に、承認用量の1/4量から開始し、毎週1/4量ずつ
漸増して承認用量(30μg/週)まで到達する漸増投与を
行った場合、漸増投与を行わなかった場合に比べて、イ
ンフルエンザ様症状の程度及び頻度が軽減したとの報告
がある5)。なお、インターフェロン ベータ-1a製剤の漸増
投与時における有効性評価は実施されていない。
15.2 非臨床試験に基づく情報
15.2.1 動物試験(サル)において、33μg/kg(体表面積で
臨床用量の100倍)の投与で、月経不順、無排卵及び血清
プロゲステロン濃度の減少が認められたとの報告がある。
16.薬物動態
16.1 血中濃度
外国人健康成人にインターフェロン ベータ-1a製剤(60μg)
を単回筋肉内投与した際の薬物動態パラメータ及び薬力学
的パラメータは以下のとおりであった6)。
〔薬物動態パラメータ:血清中IFNβ-1a濃度〕
投与量
(μg)
n
(例)
Tmax
(hr)
60
87
13.0
Cmax
AUC(0-168)
(IU/mL) (IU・hr/mL)
71.4
2,006.9
〔薬力学的パラメータ:血清中β2-MG濃度〕
投与量
(μg)
n
(例)
Tmax
(hr)
60
92
47.61
Emax
EAUC(0-168)
(μg/L) (μg・hr/L)
860
72,230
17.臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第Ⅱ相試験
日本人再発型多発性硬化症患者(25例)を対象とし、非
盲検非対照試験を実施した。インターフェロン ベータ-1a
製剤30μgを週 1 回24週間筋肉内投与し、投与前(‑12、
‑ 8 、‑ 4 及び 0 週)と投与後(12、16、20及び24週)そ
れぞれ 4 回の脳MRI検査の平均ガドリニウム(Gd)増強
病巣数を比較した結果、有効性解析対象症例(23例)に
おいて5.9個から2.8個へ有意に減少した。また、インター
フェロン ベータ-1a製剤の投与により、血清中のネオプ
テリンが誘導された7)。
〔脳MRI検査 1 回あたりのGd増強病巣数の変化〕
投与前
投与後
n(例)
23
23
平均値 標準偏差(個)
5.9 7.0
2.8 7.2
中央値〔範囲〕
(個)
2.5〔0.5-27.8〕
0.3〔0.0-32.3〕
インターフェロン ベータ-1a製剤を投与された25例中25
例(100%)に副作用が認められた。主な副作用は、イン
フルエンザ様症状20例(80%)
、発熱11例(44%)及び頭
痛 7 例(28%)であった。
17.1.2 海外第Ⅲ相臨床試験
(1)外国人再発型多発性硬化症患者を対象とした無作為
化プラセボ対照二重盲検比較試験を実施した。インター
−4−
フェロン ベータ-1a製剤30μg(158例)又はプラセボ(143
例)を週 1 回筋肉内投与したところ、身体機能障害の
持続的進行注1)開始までの期間は、Kaplan-Meier生存曲
線から、プラセボ群と比較しインターフェロン ベータ
-1a製剤群で有意に長く、投与開始後 2 年以内に身体機
能障害の持続的進行が開始する割合は、プラセボ群
34.9%、インターフェロン ベータ-1a製剤群21.9%と推
定された。また、年間再発率はプラセボ群(0.90回/例)
に比較し、インターフェロン ベータ-1a製剤群(0.61回
/例)で有意に低かった。さらに、脳MRI検査における
ガドリニウム(Gd)増強病巣数及びGd増強病巣容積は、
プラセボ群と比較しインターフェロン ベータ-1a製剤
群で有意に低かった8),9),10)。
注1)拡張身体機能障害評価スケールの1.0以上の悪化
が 6 ヵ月以上持続した場合
〔Gd増強病巣数の変化〕
投与開始前
投与開始 1 年後 投与開始 2 年後
プラセボ IFN β-1a プラセボ IFN β-1a プラセボ IFN β-1a
投与群
n(例)
132
平均値
2.32
標準誤差(個) 0.37
141
123
134
82
83
3.17
0.62
1.59
0.31
1.04
0.28
1.65
0.48
0.80
0.22
中央値
1
1
0
0
0
0
〔範囲〕
(個)〔0-23〕〔0-56〕〔0-22〕〔0-28〕〔0-34〕〔0-13〕
(2)外国人早期多発性硬化症患者注2)を対象とした無作為
化プラセボ対照二重盲検比較試験を実施した。インター
フェロン ベータ-1a製剤30μg(193例)又はプラセボ(190
例)を週 1 回筋肉内投与したところ、臨床的に診断確
実な多発性硬化症発症までの期間は、Kaplan-Meier生
存曲線からプラセボ群と比較しインターフェロン ベー
タ-1a製剤群で有意に長く(ハザード比0.56)、投与開始
後 2 年以内に臨床的に診断確実な多発性硬化症が発症
する割合は、プラセボ群で38.6%、インターフェロン
ベータ-1a製剤群で21.1%と推定された。また、脳MRI
検査におけるガドリニウム(Gd)病巣数及びGd増強病
巣容積は、プラセボ群と比較しインターフェロン ベー
タ-1a製剤群で有意に低かった。さらに、新規又は拡大
T2病巣数及びT2病巣容積については、プラセボ群と比
較しインターフェロン ベータ-1a製剤群で有意に少な
かった11),12)。
注2)初発の脱髄症状を呈し脳MRIで脱髄性の病巣を認
めた患者
〔Gd増強病巣数の変化〕
投与開始前
投与群
n(例)
投与開始
6 ヵ月後
投与開始
12ヵ月後
投与開始
18ヵ月後
プラセボ IFN β-1a プラセボ IFN β-1a プラセボ IFN β-1a プラセボ IFN β-1a
179
183
152
165
124
147
114
134
平均値
0.6
0.7
1.49
標準誤差(個) 1.39注3) 1.29注3) 0.25
0.87
0.18
1.63
0.34
0.73
0.17
1.36
0.34
0.45
0.13
0
0
0
0
0
0
0
0
中央値
〔範囲〕
(個)〔0-12〕 〔0-7〕 〔0-23〕〔0-16〕〔0-27〕〔0-20〕〔0-33〕〔0-13〕
注3)平均値 標準偏差(個)
17.2 製造販売後調査等
17.2.1 使用成績調査における副作用
使用成績調査での調査例1486例中594例(40%)に副作用
が認められた。主な副作用は発熱284例(19%)
、頭痛65
例( 4 %)、倦怠感64例( 4 %)であった。
17.2.2 製造販売後臨床試験における副作用
製造販売後臨床試験の安全性解析対象症例100例中100例
(100%)に副作用が認められた。主な副作用は、インフ
ルエンザ様疾患92例(92%)、注射部位反応30例(30%)、
発熱25例(25%)、鼻咽頭炎23例(23%)であった。
後 の 治 療 継 続 に つ い て 検 討 す る こ と が 推 奨 さ れ る。
[8.7 参照]
15.1.2 がん原性試験は行われていない。
15.1.3 海外で行われた外国人多発性硬化症患者を対象とし
たインターフェロン ベータ-1a製剤とnatalizumab(α4イ
ンテグリン拮抗薬)との併用試験において、 2 例の進行
性多巣性白質脳症(PML)が認められた。この 2 例は、
いずれもnatalizumabとインターフェロン ベータ-1a製剤
(30μg)の併用開始後 2 年以上経過した後にPMLを発症
した2)。このうち 1 例は死亡し3)、他の 1 例は重度障害を
残した4)。
15.1.4 海外で行われた外国人健康成人を対象とした試験に
おいて、インターフェロン ベータ-1a製剤の投与を開始
する際に、承認用量の1/4量から開始し、毎週1/4量ずつ
漸増して承認用量(30μg/週)まで到達する漸増投与を
行った場合、漸増投与を行わなかった場合に比べて、イ
ンフルエンザ様症状の程度及び頻度が軽減したとの報告
がある5)。なお、インターフェロン ベータ-1a製剤の漸増
投与時における有効性評価は実施されていない。
15.2 非臨床試験に基づく情報
15.2.1 動物試験(サル)において、33μg/kg(体表面積で
臨床用量の100倍)の投与で、月経不順、無排卵及び血清
プロゲステロン濃度の減少が認められたとの報告がある。
16.薬物動態
16.1 血中濃度
外国人健康成人にインターフェロン ベータ-1a製剤(60μg)
を単回筋肉内投与した際の薬物動態パラメータ及び薬力学
的パラメータは以下のとおりであった6)。
〔薬物動態パラメータ:血清中IFNβ-1a濃度〕
投与量
(μg)
n
(例)
Tmax
(hr)
60
87
13.0
Cmax
AUC(0-168)
(IU/mL) (IU・hr/mL)
71.4
2,006.9
〔薬力学的パラメータ:血清中β2-MG濃度〕
投与量
(μg)
n
(例)
Tmax
(hr)
60
92
47.61
Emax
EAUC(0-168)
(μg/L) (μg・hr/L)
860
72,230
17.臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第Ⅱ相試験
日本人再発型多発性硬化症患者(25例)を対象とし、非
盲検非対照試験を実施した。インターフェロン ベータ-1a
製剤30μgを週 1 回24週間筋肉内投与し、投与前(‑12、
‑ 8 、‑ 4 及び 0 週)と投与後(12、16、20及び24週)そ
れぞれ 4 回の脳MRI検査の平均ガドリニウム(Gd)増強
病巣数を比較した結果、有効性解析対象症例(23例)に
おいて5.9個から2.8個へ有意に減少した。また、インター
フェロン ベータ-1a製剤の投与により、血清中のネオプ
テリンが誘導された7)。
〔脳MRI検査 1 回あたりのGd増強病巣数の変化〕
投与前
投与後
n(例)
23
23
平均値 標準偏差(個)
5.9 7.0
2.8 7.2
中央値〔範囲〕
(個)
2.5〔0.5-27.8〕
0.3〔0.0-32.3〕
インターフェロン ベータ-1a製剤を投与された25例中25
例(100%)に副作用が認められた。主な副作用は、イン
フルエンザ様症状20例(80%)
、発熱11例(44%)及び頭
痛 7 例(28%)であった。
17.1.2 海外第Ⅲ相臨床試験
(1)外国人再発型多発性硬化症患者を対象とした無作為
化プラセボ対照二重盲検比較試験を実施した。インター
−4−
フェロン ベータ-1a製剤30μg(158例)又はプラセボ(143
例)を週 1 回筋肉内投与したところ、身体機能障害の
持続的進行注1)開始までの期間は、Kaplan-Meier生存曲
線から、プラセボ群と比較しインターフェロン ベータ
-1a製剤群で有意に長く、投与開始後 2 年以内に身体機
能障害の持続的進行が開始する割合は、プラセボ群
34.9%、インターフェロン ベータ-1a製剤群21.9%と推
定された。また、年間再発率はプラセボ群(0.90回/例)
に比較し、インターフェロン ベータ-1a製剤群(0.61回
/例)で有意に低かった。さらに、脳MRI検査における
ガドリニウム(Gd)増強病巣数及びGd増強病巣容積は、
プラセボ群と比較しインターフェロン ベータ-1a製剤
群で有意に低かった8),9),10)。
注1)拡張身体機能障害評価スケールの1.0以上の悪化
が 6 ヵ月以上持続した場合
〔Gd増強病巣数の変化〕
投与開始前
投与開始 1 年後 投与開始 2 年後
プラセボ IFN β-1a プラセボ IFN β-1a プラセボ IFN β-1a
投与群
n(例)
132
平均値
2.32
標準誤差(個) 0.37
141
123
134
82
83
3.17
0.62
1.59
0.31
1.04
0.28
1.65
0.48
0.80
0.22
中央値
1
1
0
0
0
0
〔範囲〕
(個)〔0-23〕〔0-56〕〔0-22〕〔0-28〕〔0-34〕〔0-13〕
(2)外国人早期多発性硬化症患者注2)を対象とした無作為
化プラセボ対照二重盲検比較試験を実施した。インター
フェロン ベータ-1a製剤30μg(193例)又はプラセボ(190
例)を週 1 回筋肉内投与したところ、臨床的に診断確
実な多発性硬化症発症までの期間は、Kaplan-Meier生
存曲線からプラセボ群と比較しインターフェロン ベー
タ-1a製剤群で有意に長く(ハザード比0.56)、投与開始
後 2 年以内に臨床的に診断確実な多発性硬化症が発症
する割合は、プラセボ群で38.6%、インターフェロン
ベータ-1a製剤群で21.1%と推定された。また、脳MRI
検査におけるガドリニウム(Gd)病巣数及びGd増強病
巣容積は、プラセボ群と比較しインターフェロン ベー
タ-1a製剤群で有意に低かった。さらに、新規又は拡大
T2病巣数及びT2病巣容積については、プラセボ群と比
較しインターフェロン ベータ-1a製剤群で有意に少な
かった11),12)。
注2)初発の脱髄症状を呈し脳MRIで脱髄性の病巣を認
めた患者
〔Gd増強病巣数の変化〕
投与開始前
投与群
n(例)
投与開始
6 ヵ月後
投与開始
12ヵ月後
投与開始
18ヵ月後
プラセボ IFN β-1a プラセボ IFN β-1a プラセボ IFN β-1a プラセボ IFN β-1a
179
183
152
165
124
147
114
134
平均値
0.6
0.7
1.49
標準誤差(個) 1.39注3) 1.29注3) 0.25
0.87
0.18
1.63
0.34
0.73
0.17
1.36
0.34
0.45
0.13
0
0
0
0
0
0
0
0
中央値
〔範囲〕
(個)〔0-12〕 〔0-7〕 〔0-23〕〔0-16〕〔0-27〕〔0-20〕〔0-33〕〔0-13〕
注3)平均値 標準偏差(個)
17.2 製造販売後調査等
17.2.1 使用成績調査における副作用
使用成績調査での調査例1486例中594例(40%)に副作用
が認められた。主な副作用は発熱284例(19%)
、頭痛65
例( 4 %)、倦怠感64例( 4 %)であった。
17.2.2 製造販売後臨床試験における副作用
製造販売後臨床試験の安全性解析対象症例100例中100例
(100%)に副作用が認められた。主な副作用は、インフ
ルエンザ様疾患92例(92%)、注射部位反応30例(30%)、
発熱25例(25%)、鼻咽頭炎23例(23%)であった。