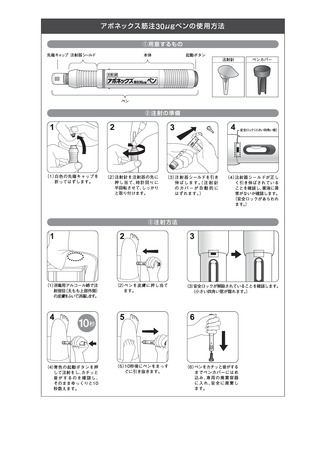
よむ、つかう、まなぶ。
資料2-3 インターフェロンベータ-1a(遺伝子組換え)及びインターフェロンベータ-1b(遺伝子組換え)の電子化された添付文書一覧 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
者への説明を十分行い、治療上の必要性を十分検討
の上投与すること。
8.5 本剤の投与にあたっては、抑うつ、自殺企図をはじ
め、躁状態、攻撃的行動、不眠、不安、焦燥、興奮、
攻撃性、易刺激性等の精神神経症状発現の可能性に
ついて患者及びその家族に十分理解させ、これらの
症状があらわれた場合には直ちに連絡するよう注意
を与えること。[1.1、9.1.1、11.1.1 参照]
8.6 骨髄抑制を起こすことがあるので、投与開始前及び
投与中は定期的に血液検査(白血球、血小板等)を行
うなど患者の状態を十分に観察すること。[9.1.3、
11.1.6 参照]
8.7 肝機能障害を起こすことがあるので、投与開始前及
び投与中は肝機能検査(AST、ALT、γ-GTP等)を
定期的に(1~3ヵ月に1回)行うなど患者の状態を十
分に観察すること。肝機能障害の既往のある患者で
は、投与開始1~2週後にも検査を実施することが望
ましい。[9.3.1、9.3.3、11.1.7 参照]
8.8 過敏症の反応を予測するため、使用に際しては十分
な問診を行うとともに、予め本剤によるプリック試
験を行うことが望ましい。[2.1、11.1.5 参照]
8.9 本剤を自己投与させる場合、患者に投与法の指導を
行うこと。
8.9.1 投与する際の無菌的操作法を患者に指導すること。
溶解や自己投与に関する適切な指導を行うこと。
最初の自己投与は医師の指導の下に行うこと。
8.9.2 注射針あるいは注射器を再使用しないように患者
に注意を促し、安全な廃棄方法を指導すること。
すべての容器の安全な廃棄方法に関する指導を行
うと同時に、使用済みの針及び注射器を廃棄する
容器を提供すること。
8.10 本剤の投与初期において、一般にインフルエンザ様
症状(発熱、頭痛、倦怠感、関節痛、悪寒、筋肉痛、
発汗等)があらわれる。また、発熱の程度は個人差
が著しいが、高熱を呈する場合もあるので、発熱に
対して予め十分配慮すること。
8.11 本剤の投与中は尿検査(尿タンパク)を定期的に行う
こと。[9.2.1、11.1.12、11.1.16 参照]
8.12 投与を一時中止し、再投与する場合、ショック等の
過敏症があらわれることがあるので慎重に投与する
こと。[11.1.5 参照]
8.13 間質性肺炎があらわれることがあるので、咳、呼吸
困難等があらわれた場合には直ちに連絡するよう患
者に対し注意を与えること。[1.1、11.1.2 参照]
8.14 血栓性血小板減少性紫斑病(TTP)、溶血性尿毒症症
候群(HUS)があらわれることがあるので、定期的に
血液検査(血小板数、赤血球数等)及び腎機能検査を
行うこと。[11.1.13 参照]
8.15 糖尿病があらわれることがあるので、定期的に検査
(血糖値、尿糖等)を行うこと。[9.1.7、11.1.14 参照]
8.16 急性腎障害があらわれることがあるので、定期的に
腎機能検査を行うこと。[9.2.1、11.1.16 参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 精神神経障害又はその既往歴のある患者(ただし
重度のうつ病又は自殺念慮の既往歴のある患者を
除く)
症状が悪化するおそれがある。[1.1、2.3、8.5、
11.1.1 参照]
9.1.2 心疾患又はその既往歴のある患者
症状が悪化するおそれがある。
-2-
9.1.3 骨髄抑制、貧血又は血小板減少症の患者
高度の白血球減少又は血小板減少を起こすことが
あり、感染症又は出血傾向をきたすおそれがある。
[8.6、11.1.6 参照]
9.1.4 てんかん等のけいれん性疾患又はこれらの既往歴
のある患者(ただし治療により十分な管理がされ
ていないてんかん患者を除く)
症状が悪化するおそれがある。[2.6、11.1.4 参照]
9.1.5 アレルギー素因のある患者
[11.1.5 参照]
9.1.6 高血圧症を有する患者
脳出血等があらわれるおそれがある。[11.1.17 参
照]
9.1.7 糖尿病患者又はその既往歴、家族歴、耐糖能障害
のある患者
糖尿病があらわれる又は増悪するおそれがある。
[8.15、11.1.14 参照]
9.1.8 多発性硬化症以外の自己免疫疾患(ただし自己免
疫性肝炎を除く)のある患者又はその素因のある
患者
症状が悪化するおそれがある。[9.3.2、11.1.11 参
照]
9.1.9 薬物過敏症の既往歴のある患者
[11.1.5 参照]
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
症 状 が 悪 化 す る お そ れ が あ る 。[ 8 . 1 1 、 8 . 1 6 、
11.1.12、11.1.16 参照]
9.3 肝機能障害患者
9.3.1 非代償性肝疾患の患者
投与しないこと。症状が悪化するおそれがある。
[2.4、8.7、11.1.7 参照]
9.3.2 自己免疫性肝炎の患者
投与しないこと。肝炎が悪化するおそれがある。
[2.5、9.1.8、11.1.11 参照]
9.3.3 重篤な肝障害のある患者(ただし非代償性肝疾患
の患者又は自己免疫性肝炎の患者を除く)
症状が悪化するおそれがある。[8.7、11.1.7 参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与し
ないこと。動物実験(サル)において高用量の投与で
胎児死亡・流産が認められたとの報告がある。[2.2
参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授
乳の継続又は中止を検討すること。授乳ラットに本
剤の125I-標識体(72万国際単位/kg)を単回皮下投与し
たとき、乳汁中に放射能が検出され、乳汁中への移
行が認められた。[16.5.2 参照]
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一
般に生理機能が低下している。
の上投与すること。
8.5 本剤の投与にあたっては、抑うつ、自殺企図をはじ
め、躁状態、攻撃的行動、不眠、不安、焦燥、興奮、
攻撃性、易刺激性等の精神神経症状発現の可能性に
ついて患者及びその家族に十分理解させ、これらの
症状があらわれた場合には直ちに連絡するよう注意
を与えること。[1.1、9.1.1、11.1.1 参照]
8.6 骨髄抑制を起こすことがあるので、投与開始前及び
投与中は定期的に血液検査(白血球、血小板等)を行
うなど患者の状態を十分に観察すること。[9.1.3、
11.1.6 参照]
8.7 肝機能障害を起こすことがあるので、投与開始前及
び投与中は肝機能検査(AST、ALT、γ-GTP等)を
定期的に(1~3ヵ月に1回)行うなど患者の状態を十
分に観察すること。肝機能障害の既往のある患者で
は、投与開始1~2週後にも検査を実施することが望
ましい。[9.3.1、9.3.3、11.1.7 参照]
8.8 過敏症の反応を予測するため、使用に際しては十分
な問診を行うとともに、予め本剤によるプリック試
験を行うことが望ましい。[2.1、11.1.5 参照]
8.9 本剤を自己投与させる場合、患者に投与法の指導を
行うこと。
8.9.1 投与する際の無菌的操作法を患者に指導すること。
溶解や自己投与に関する適切な指導を行うこと。
最初の自己投与は医師の指導の下に行うこと。
8.9.2 注射針あるいは注射器を再使用しないように患者
に注意を促し、安全な廃棄方法を指導すること。
すべての容器の安全な廃棄方法に関する指導を行
うと同時に、使用済みの針及び注射器を廃棄する
容器を提供すること。
8.10 本剤の投与初期において、一般にインフルエンザ様
症状(発熱、頭痛、倦怠感、関節痛、悪寒、筋肉痛、
発汗等)があらわれる。また、発熱の程度は個人差
が著しいが、高熱を呈する場合もあるので、発熱に
対して予め十分配慮すること。
8.11 本剤の投与中は尿検査(尿タンパク)を定期的に行う
こと。[9.2.1、11.1.12、11.1.16 参照]
8.12 投与を一時中止し、再投与する場合、ショック等の
過敏症があらわれることがあるので慎重に投与する
こと。[11.1.5 参照]
8.13 間質性肺炎があらわれることがあるので、咳、呼吸
困難等があらわれた場合には直ちに連絡するよう患
者に対し注意を与えること。[1.1、11.1.2 参照]
8.14 血栓性血小板減少性紫斑病(TTP)、溶血性尿毒症症
候群(HUS)があらわれることがあるので、定期的に
血液検査(血小板数、赤血球数等)及び腎機能検査を
行うこと。[11.1.13 参照]
8.15 糖尿病があらわれることがあるので、定期的に検査
(血糖値、尿糖等)を行うこと。[9.1.7、11.1.14 参照]
8.16 急性腎障害があらわれることがあるので、定期的に
腎機能検査を行うこと。[9.2.1、11.1.16 参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 精神神経障害又はその既往歴のある患者(ただし
重度のうつ病又は自殺念慮の既往歴のある患者を
除く)
症状が悪化するおそれがある。[1.1、2.3、8.5、
11.1.1 参照]
9.1.2 心疾患又はその既往歴のある患者
症状が悪化するおそれがある。
-2-
9.1.3 骨髄抑制、貧血又は血小板減少症の患者
高度の白血球減少又は血小板減少を起こすことが
あり、感染症又は出血傾向をきたすおそれがある。
[8.6、11.1.6 参照]
9.1.4 てんかん等のけいれん性疾患又はこれらの既往歴
のある患者(ただし治療により十分な管理がされ
ていないてんかん患者を除く)
症状が悪化するおそれがある。[2.6、11.1.4 参照]
9.1.5 アレルギー素因のある患者
[11.1.5 参照]
9.1.6 高血圧症を有する患者
脳出血等があらわれるおそれがある。[11.1.17 参
照]
9.1.7 糖尿病患者又はその既往歴、家族歴、耐糖能障害
のある患者
糖尿病があらわれる又は増悪するおそれがある。
[8.15、11.1.14 参照]
9.1.8 多発性硬化症以外の自己免疫疾患(ただし自己免
疫性肝炎を除く)のある患者又はその素因のある
患者
症状が悪化するおそれがある。[9.3.2、11.1.11 参
照]
9.1.9 薬物過敏症の既往歴のある患者
[11.1.5 参照]
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
症 状 が 悪 化 す る お そ れ が あ る 。[ 8 . 1 1 、 8 . 1 6 、
11.1.12、11.1.16 参照]
9.3 肝機能障害患者
9.3.1 非代償性肝疾患の患者
投与しないこと。症状が悪化するおそれがある。
[2.4、8.7、11.1.7 参照]
9.3.2 自己免疫性肝炎の患者
投与しないこと。肝炎が悪化するおそれがある。
[2.5、9.1.8、11.1.11 参照]
9.3.3 重篤な肝障害のある患者(ただし非代償性肝疾患
の患者又は自己免疫性肝炎の患者を除く)
症状が悪化するおそれがある。[8.7、11.1.7 参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与し
ないこと。動物実験(サル)において高用量の投与で
胎児死亡・流産が認められたとの報告がある。[2.2
参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授
乳の継続又は中止を検討すること。授乳ラットに本
剤の125I-標識体(72万国際単位/kg)を単回皮下投与し
たとき、乳汁中に放射能が検出され、乳汁中への移
行が認められた。[16.5.2 参照]
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一
般に生理機能が低下している。