よむ、つかう、まなぶ。
資料2-3 インターフェロンベータ-1a(遺伝子組換え)及びインターフェロンベータ-1b(遺伝子組換え)の電子化された添付文書一覧 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和4年3月22日
令和3年度医薬品等安全対策調査会
日本標準商品分類番号
資料2-3
*2021年 6 月改訂(第 1 版)
876399
貯
法: 2 〜 8 ℃で保存する。
有効期間:36ヵ月
遺伝子組換え型インターフェロンβ-1a製剤
インターフェロン ベータ-1a(遺伝子組換え)筋注用液状製剤
承認番号
22500AMX01909
販売開始
2014年 6 月
規制区分:生物由来製品 劇薬・処方箋医薬品注)
注)注意−医師等の処方箋により使用すること
5.効能・効果に関連する注意
1.警告
1.1 本剤又は他のインターフェロン製剤の投与によりうつ
病や自殺企図が報告されているので、投与にあたっては、
うつ病、自殺企図の症状又は他の精神神経症状があらわ
れた場合には直ちに医師に連絡するように注意を与える
こと。[2.3、8.8、9.1.1、11.1.1 参照]
1.2 間質性肺炎があらわれることがあるので、投与にあたっ
ては、患者の状態を十分に観察し、呼吸困難等があらわ
れた場合には、直ちに医師に連絡するように注意を与え
ること。[8.10、11.1.8 参照]
2.禁忌(次の患者には投与しないこと)
2.1 本剤の成分又は他のインターフェロン製剤に対し過敏
症の既往歴のある患者[8.2、11.1.2、11.1.15 参照]
2.2 妊婦又は妊娠している可能性のある女性[9.5 参照]
2.3 重度のうつ病又は自殺念慮のある患者又はその既往歴
のある患者[うつ病や自殺企図があらわれることがある。]
[1.1、9.1.1、11.1.1 参照]
2.4 非代償性肝疾患の患者[9.3.1、11.1.7 参照]
2.5 自己免疫性肝炎の患者[9.3.2、11.1.6 参照]
2.6 治療による管理が十分なされていないてんかん患者[症
状が悪化するおそれがある。][9.1.2、11.1.4 参照]
2.7 小柴胡湯を投与中の患者[10.1 参照]
2.8 ワクチン等生物学的製剤に対し過敏症の既往歴のある
患者
3.組成・性状
3.1 組成
販
売
アボネックス®筋注30μgペン
名
成分・分量
有効成分
インターフェロン ベータ-1a
注1)
( 1 製剤(0.5mL)中) (遺伝子組換え)
30μg
酢酸ナトリウム水和物
0.79mg
氷酢酸
0.25mg
添 加 剤
( 1 製剤(0.5mL)
中) L-アルギニン塩酸塩
ポリソルベート20
15.8mg
0.025mg
注1)チャイニーズハムスター卵巣細胞により産生
3.2 製剤の性状
販
売
アボネックス®筋注30μgペン
名
性
外
観
無色澄明な液剤
状
pH
4.5〜5.1
浸透圧比注2)
約1
注2)生理食塩液に対する比
4.効能・効果
多発性硬化症の再発予防
−1−
進行型多発性硬化症に対する本剤の有効性及び安全性は確立
していない。
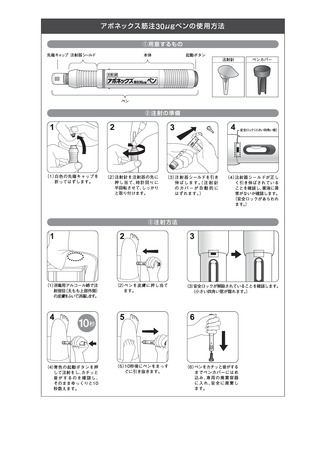
6.用法・用量
通常、成人にはインターフェロン ベータ-1a(遺伝子組換え)
として 1 回30μgを週一回筋肉内投与する。
7.用法・用量に関連する注意
7.1 投与部位は大腿上部外側とすること。
7.2 注射部位反応(発赤、発疹等)が報告されているので、
投与ごとに注射部位を変えること。
8.重要な基本的注意
8.1 本剤の投与初期においてインフルエンザ様症状(発熱、
悪寒、頭痛、筋痛、無力症、疲労、悪心及び嘔吐等)があ
らわれるので、その旨を患者にあらかじめ説明しておくこ
と。投与数時間〜数日後にあらわれることもあるので、投
与後数日間は慎重に観察するとともに、異常が認められた
場合には、解熱消炎鎮痛薬の併用等適切な処置を行うこと。
8.2 過敏症等の反応を予測するため、使用に際しては十分な
問診を行うとともに、あらかじめ本剤によるプリック試験
を行うことが望ましい。[2.1、11.1.2、11.1.15 参照]
8.3 劇症肝炎等の重篤な肝障害があらわれることがある。投
与開始前及び投与中は肝機能検査(AST、ALT、γ-GTP等)
を定期的に( 1 〜 3 ヵ月に 1 回)行うなど患者の状態を十
分に観察し、異常が認められた場合には減量、休薬等の適
切な処置を行うこと。肝機能障害の既往のある患者では、
投与開始 1 〜 2 週間後にも検査をすることが望ましい。ま
た、肝機能障害が報告されている薬剤やアルコールなどと
本剤の併用により肝障害が発現する可能性があるので、そ
れらと併用する際には十分注意すること。また、本剤投与
後に悪心・嘔吐、倦怠感、食欲不振、尿濃染、眼球結膜黄
染等の症状があらわれた場合には、医師等に連絡するよう
患者に指導すること。[9.3.1、9.3.3、11.1.7 参照]
8.4 汎血球減少症、白血球減少又は血小板減少等の血球数減
少を起こすことがあるので、白血球分画及び血小板数を含
む血液検査を定期的に行い、患者の状態を十分に観察する
こと。[9.1.4、11.1.3 参照]
8.5 本剤投与中は尿検査(尿蛋白)を定期的に行うこと。
[9.
2.
1、
11.1.13、11.1.17 参照]
8.6 自己投与の適用については、医師がその妥当性を検討し、
患者に対し十分な教育訓練を実施した後、本剤投与による
危険性と対処法を理解させ、患者自らが筋肉内に確実に投
与できることを確認した上で、医師の管理指導の下で実施
すること。また、適用後、感染等本剤による副作用が疑わ
れる場合や自己投与の継続が困難な状況となる可能性があ
る場合には、直ちに自己投与を中止させ、医師の管理下で
慎重に観察するなど適切な処置を行うこと。
使用済みの注射針あるいは注射器を再使用しないように患
令和3年度医薬品等安全対策調査会
日本標準商品分類番号
資料2-3
*2021年 6 月改訂(第 1 版)
876399
貯
法: 2 〜 8 ℃で保存する。
有効期間:36ヵ月
遺伝子組換え型インターフェロンβ-1a製剤
インターフェロン ベータ-1a(遺伝子組換え)筋注用液状製剤
承認番号
22500AMX01909
販売開始
2014年 6 月
規制区分:生物由来製品 劇薬・処方箋医薬品注)
注)注意−医師等の処方箋により使用すること
5.効能・効果に関連する注意
1.警告
1.1 本剤又は他のインターフェロン製剤の投与によりうつ
病や自殺企図が報告されているので、投与にあたっては、
うつ病、自殺企図の症状又は他の精神神経症状があらわ
れた場合には直ちに医師に連絡するように注意を与える
こと。[2.3、8.8、9.1.1、11.1.1 参照]
1.2 間質性肺炎があらわれることがあるので、投与にあたっ
ては、患者の状態を十分に観察し、呼吸困難等があらわ
れた場合には、直ちに医師に連絡するように注意を与え
ること。[8.10、11.1.8 参照]
2.禁忌(次の患者には投与しないこと)
2.1 本剤の成分又は他のインターフェロン製剤に対し過敏
症の既往歴のある患者[8.2、11.1.2、11.1.15 参照]
2.2 妊婦又は妊娠している可能性のある女性[9.5 参照]
2.3 重度のうつ病又は自殺念慮のある患者又はその既往歴
のある患者[うつ病や自殺企図があらわれることがある。]
[1.1、9.1.1、11.1.1 参照]
2.4 非代償性肝疾患の患者[9.3.1、11.1.7 参照]
2.5 自己免疫性肝炎の患者[9.3.2、11.1.6 参照]
2.6 治療による管理が十分なされていないてんかん患者[症
状が悪化するおそれがある。][9.1.2、11.1.4 参照]
2.7 小柴胡湯を投与中の患者[10.1 参照]
2.8 ワクチン等生物学的製剤に対し過敏症の既往歴のある
患者
3.組成・性状
3.1 組成
販
売
アボネックス®筋注30μgペン
名
成分・分量
有効成分
インターフェロン ベータ-1a
注1)
( 1 製剤(0.5mL)中) (遺伝子組換え)
30μg
酢酸ナトリウム水和物
0.79mg
氷酢酸
0.25mg
添 加 剤
( 1 製剤(0.5mL)
中) L-アルギニン塩酸塩
ポリソルベート20
15.8mg
0.025mg
注1)チャイニーズハムスター卵巣細胞により産生
3.2 製剤の性状
販
売
アボネックス®筋注30μgペン
名
性
外
観
無色澄明な液剤
状
pH
4.5〜5.1
浸透圧比注2)
約1
注2)生理食塩液に対する比
4.効能・効果
多発性硬化症の再発予防
−1−
進行型多発性硬化症に対する本剤の有効性及び安全性は確立
していない。
6.用法・用量
通常、成人にはインターフェロン ベータ-1a(遺伝子組換え)
として 1 回30μgを週一回筋肉内投与する。
7.用法・用量に関連する注意
7.1 投与部位は大腿上部外側とすること。
7.2 注射部位反応(発赤、発疹等)が報告されているので、
投与ごとに注射部位を変えること。
8.重要な基本的注意
8.1 本剤の投与初期においてインフルエンザ様症状(発熱、
悪寒、頭痛、筋痛、無力症、疲労、悪心及び嘔吐等)があ
らわれるので、その旨を患者にあらかじめ説明しておくこ
と。投与数時間〜数日後にあらわれることもあるので、投
与後数日間は慎重に観察するとともに、異常が認められた
場合には、解熱消炎鎮痛薬の併用等適切な処置を行うこと。
8.2 過敏症等の反応を予測するため、使用に際しては十分な
問診を行うとともに、あらかじめ本剤によるプリック試験
を行うことが望ましい。[2.1、11.1.2、11.1.15 参照]
8.3 劇症肝炎等の重篤な肝障害があらわれることがある。投
与開始前及び投与中は肝機能検査(AST、ALT、γ-GTP等)
を定期的に( 1 〜 3 ヵ月に 1 回)行うなど患者の状態を十
分に観察し、異常が認められた場合には減量、休薬等の適
切な処置を行うこと。肝機能障害の既往のある患者では、
投与開始 1 〜 2 週間後にも検査をすることが望ましい。ま
た、肝機能障害が報告されている薬剤やアルコールなどと
本剤の併用により肝障害が発現する可能性があるので、そ
れらと併用する際には十分注意すること。また、本剤投与
後に悪心・嘔吐、倦怠感、食欲不振、尿濃染、眼球結膜黄
染等の症状があらわれた場合には、医師等に連絡するよう
患者に指導すること。[9.3.1、9.3.3、11.1.7 参照]
8.4 汎血球減少症、白血球減少又は血小板減少等の血球数減
少を起こすことがあるので、白血球分画及び血小板数を含
む血液検査を定期的に行い、患者の状態を十分に観察する
こと。[9.1.4、11.1.3 参照]
8.5 本剤投与中は尿検査(尿蛋白)を定期的に行うこと。
[9.
2.
1、
11.1.13、11.1.17 参照]
8.6 自己投与の適用については、医師がその妥当性を検討し、
患者に対し十分な教育訓練を実施した後、本剤投与による
危険性と対処法を理解させ、患者自らが筋肉内に確実に投
与できることを確認した上で、医師の管理指導の下で実施
すること。また、適用後、感染等本剤による副作用が疑わ
れる場合や自己投与の継続が困難な状況となる可能性があ
る場合には、直ちに自己投与を中止させ、医師の管理下で
慎重に観察するなど適切な処置を行うこと。
使用済みの注射針あるいは注射器を再使用しないように患