よむ、つかう、まなぶ。
【資料1】国際共同治験に参加する場合の日本人第1相試験の必要性について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34601.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第2回 8/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
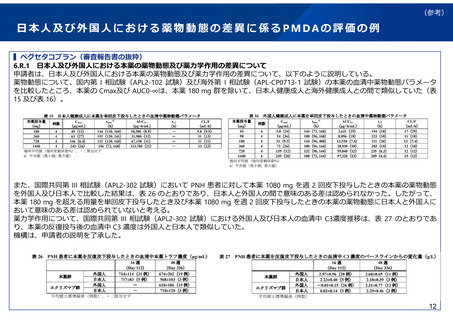
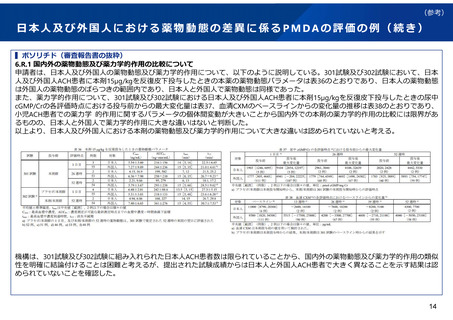
日本人第1相試験において日本人特有の安全性の懸念が見られた例
日本人第1相試験を実施したことにより、外国人と異なる、日本人において特有の安全性の懸念が見られた例は限られるものの、以下
のようなものがある。
本剤については、類薬(他のアセチルコリンエステラーゼ阻害剤)においても日本人では消化器系副作用の発現に注意する必要がある
ことが経験的に知られており、このような類薬における安全性の民族差も日本人第1相試験実施の必要性を検討する上で考慮すべき要
因になるものと考えられる。
なお、本剤は別剤形での申請が行われれたためPMDAの審査において把握することができたが、単に日本での開発が中止となった品目に
ついては、通常、詳細な理由やデータは把握することはできない。
▍リバスチグミンカプセル
日本人アルツハイマー病患者を対象に実施された第1相試験において、本薬2mg/日から開始し、2週間ごとに2mg/日ずつ増量する
こととされた。4例が組み入れられ、3例において6mg/日以上投与時に有害事象が認められた。有害事象は嘔吐、食欲低下、下痢が
各2例、便失禁、イレウス、食道裂孔ヘルニア、逆流性誤嚥性肺炎が各1例であった。3例中2例は減量で軽快したが、1例は嘔吐物
の誤飲によって発現した肺炎により死亡した(治験薬との因果関係は否定された)。
この結果を受けて、本薬の日本でのカプセル剤の開発は中止され、副作用の軽減が示された貼付剤の開発が進められた(2011年4月
承認済)。
欧米では、カプセル剤が承認されている。米国での添付文書によると、カプセル剤に係る臨床試験での主要な有害事象の発現頻度は、
1,189例中、吐き気47%、嘔吐31%、食欲不振17%、めまい21%とされている。
15
日本人第1相試験を実施したことにより、外国人と異なる、日本人において特有の安全性の懸念が見られた例は限られるものの、以下
のようなものがある。
本剤については、類薬(他のアセチルコリンエステラーゼ阻害剤)においても日本人では消化器系副作用の発現に注意する必要がある
ことが経験的に知られており、このような類薬における安全性の民族差も日本人第1相試験実施の必要性を検討する上で考慮すべき要
因になるものと考えられる。
なお、本剤は別剤形での申請が行われれたためPMDAの審査において把握することができたが、単に日本での開発が中止となった品目に
ついては、通常、詳細な理由やデータは把握することはできない。
▍リバスチグミンカプセル
日本人アルツハイマー病患者を対象に実施された第1相試験において、本薬2mg/日から開始し、2週間ごとに2mg/日ずつ増量する
こととされた。4例が組み入れられ、3例において6mg/日以上投与時に有害事象が認められた。有害事象は嘔吐、食欲低下、下痢が
各2例、便失禁、イレウス、食道裂孔ヘルニア、逆流性誤嚥性肺炎が各1例であった。3例中2例は減量で軽快したが、1例は嘔吐物
の誤飲によって発現した肺炎により死亡した(治験薬との因果関係は否定された)。
この結果を受けて、本薬の日本でのカプセル剤の開発は中止され、副作用の軽減が示された貼付剤の開発が進められた(2011年4月
承認済)。
欧米では、カプセル剤が承認されている。米国での添付文書によると、カプセル剤に係る臨床試験での主要な有害事象の発現頻度は、
1,189例中、吐き気47%、嘔吐31%、食欲不振17%、めまい21%とされている。
15