よむ、つかう、まなぶ。
【資料1】国際共同治験に参加する場合の日本人第1相試験の必要性について (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34601.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第2回 8/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
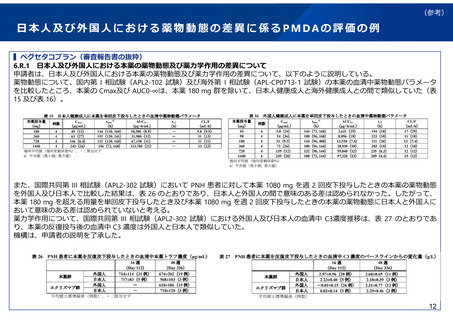
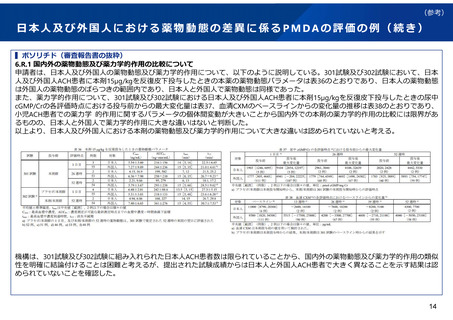
実際の審査品目における日本人第1相試験の実施状況
令和4年度に承認された新有効成分含有医薬品(ワクチンを除く)は32品目であった。
このうち、国際共同治験を評価資料として承認されている品目は21品目あり、日本人第1相試験を実施してい
ない品目は、ボソリチド(軟骨無形成症)、カボテグラビル/リルピビリン(HIV-1感染症)の2品目であった。
また、国内試験等を主要な臨床成績として承認されている品目であって、日本人第1相試験を実施しなかった
ものは、ペグバリアーゼ(フェニルケトン尿症)、コール酸(先天性胆汁酸代謝異常症)、抗ヒト胸腺細胞ウ
マ免疫グロブリン(再生不良性貧血)の3品目であった。
日本人第1相試験を実施しなくともその後の臨床試験に日本人が参加することが認められた理由としては、患
者数が限られている等の医療ニーズが高い疾患であることや、第3相試験において日本人の安全性に十分配慮
する計画(※)であったことなどが挙げられる。なお、これらの5品目はいずれも希少疾病用医薬品の指定を受
けている。
(※)一般に、第3相試験において、日本人については同時ではなく段階的に組み入れることや、投与初期は(例えばPKデータ取得のた
め)入院、頻回の来院、投与後の一定時間の観察を行うこと、日本人のみ低用量から開始するなどのいわゆるSafety run inコホートを設定、
といった対応が想定される。
なお、これら32品目については、日本人第1相試験を実施していない品目を含め、臨床データパッケージに含
まれる第3相国際共同治験等に基づく解析により薬物動態について日本人と外国人の間で臨床的に問題となる
違いは認められていない(具体的な評価の内容の例は参考参照)。ただし、あくまで結果論であり、それだけ
をもって日本人第1相試験の要否について安易に判断するべきものではないと考えられる。
11
令和4年度に承認された新有効成分含有医薬品(ワクチンを除く)は32品目であった。
このうち、国際共同治験を評価資料として承認されている品目は21品目あり、日本人第1相試験を実施してい
ない品目は、ボソリチド(軟骨無形成症)、カボテグラビル/リルピビリン(HIV-1感染症)の2品目であった。
また、国内試験等を主要な臨床成績として承認されている品目であって、日本人第1相試験を実施しなかった
ものは、ペグバリアーゼ(フェニルケトン尿症)、コール酸(先天性胆汁酸代謝異常症)、抗ヒト胸腺細胞ウ
マ免疫グロブリン(再生不良性貧血)の3品目であった。
日本人第1相試験を実施しなくともその後の臨床試験に日本人が参加することが認められた理由としては、患
者数が限られている等の医療ニーズが高い疾患であることや、第3相試験において日本人の安全性に十分配慮
する計画(※)であったことなどが挙げられる。なお、これらの5品目はいずれも希少疾病用医薬品の指定を受
けている。
(※)一般に、第3相試験において、日本人については同時ではなく段階的に組み入れることや、投与初期は(例えばPKデータ取得のた
め)入院、頻回の来院、投与後の一定時間の観察を行うこと、日本人のみ低用量から開始するなどのいわゆるSafety run inコホートを設定、
といった対応が想定される。
なお、これら32品目については、日本人第1相試験を実施していない品目を含め、臨床データパッケージに含
まれる第3相国際共同治験等に基づく解析により薬物動態について日本人と外国人の間で臨床的に問題となる
違いは認められていない(具体的な評価の内容の例は参考参照)。ただし、あくまで結果論であり、それだけ
をもって日本人第1相試験の要否について安易に判断するべきものではないと考えられる。
11