よむ、つかう、まなぶ。
【資料3】第四期医療費適正化基本方針について (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33914.html |
| 出典情報 | 社会保障審議会医療保険部会(第165回 6/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和5年4月28日
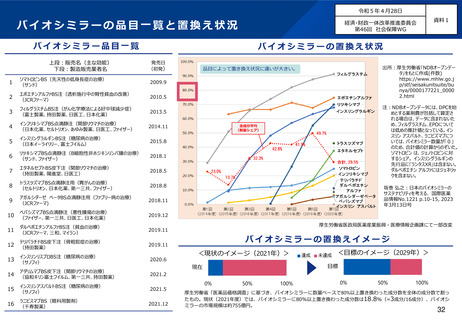
バイオシミラーについて
経済・財政一体改革推進委員会
第46回 社会保障WG
資料1
バイオ医薬品の特徴
バイオ医薬品とは、遺伝子組換え技術や細胞培養技術等
を応用して、微生物や細胞が 持つタンパク質(ホルモン、
酵素、抗体等)等を作る力を利用して製造される医薬品。
例:インスリン(糖尿病治療薬)
インターフェロン(C型肝炎治療薬)
リツキシマブ(抗がん剤等)
バイオ後続品(バイオシミラー)
•
•
•
薬事承認において、後発医薬品は、先発医薬品との有効成
分の同一性や血中濃度推移で評価される。
バイオシミラーでは、複雑な構造、不安定性等の品質特性
から、先行バイオ医薬品との有効成分の同一性等の検証が
困難。
そのため、品質の類似性に加え、臨床試験等によって、先
行バイオ医薬品と同じ効能・効果、用法・用量で使える
(=同等/同質である)ことを検証している。
後発医薬品
バイオシミラー
先発品/先行医薬品
化学合成医薬品
バイオ医薬品
後発品に求められる条件
(有効成分の品質特性)
有効成分、成分量等が
先発品と同一である
品質・有効性等が
先行バイオ医薬品と
同等/同質である
開発上重要なポイント
主に製剤
主に原薬
臨床試験
生物学的同等性試験に
よる評価が基本
同等性/同質性を
評価する治験が必要
製造販売後調査
原則
実施しない
原則
実施する
31
バイオシミラーについて
経済・財政一体改革推進委員会
第46回 社会保障WG
資料1
バイオ医薬品の特徴
バイオ医薬品とは、遺伝子組換え技術や細胞培養技術等
を応用して、微生物や細胞が 持つタンパク質(ホルモン、
酵素、抗体等)等を作る力を利用して製造される医薬品。
例:インスリン(糖尿病治療薬)
インターフェロン(C型肝炎治療薬)
リツキシマブ(抗がん剤等)
バイオ後続品(バイオシミラー)
•
•
•
薬事承認において、後発医薬品は、先発医薬品との有効成
分の同一性や血中濃度推移で評価される。
バイオシミラーでは、複雑な構造、不安定性等の品質特性
から、先行バイオ医薬品との有効成分の同一性等の検証が
困難。
そのため、品質の類似性に加え、臨床試験等によって、先
行バイオ医薬品と同じ効能・効果、用法・用量で使える
(=同等/同質である)ことを検証している。
後発医薬品
バイオシミラー
先発品/先行医薬品
化学合成医薬品
バイオ医薬品
後発品に求められる条件
(有効成分の品質特性)
有効成分、成分量等が
先発品と同一である
品質・有効性等が
先行バイオ医薬品と
同等/同質である
開発上重要なポイント
主に製剤
主に原薬
臨床試験
生物学的同等性試験に
よる評価が基本
同等性/同質性を
評価する治験が必要
製造販売後調査
原則
実施しない
原則
実施する
31