よむ、つかう、まなぶ。
総-2参考1○最適使用推進ガイドラインについて (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00190.html |
| 出典情報 | 中央社会保険医療協議会 総会(第546回 6/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
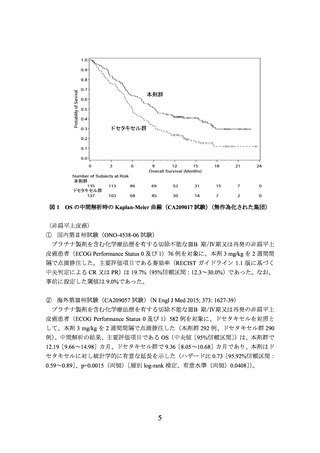
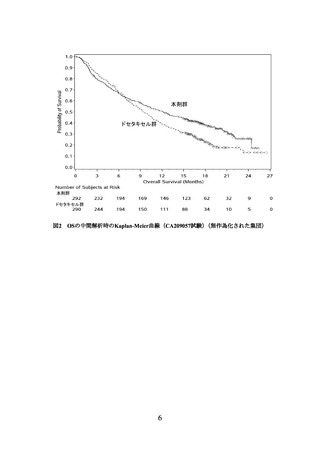
(PD-L1発現状況別の有効性及び安全性)
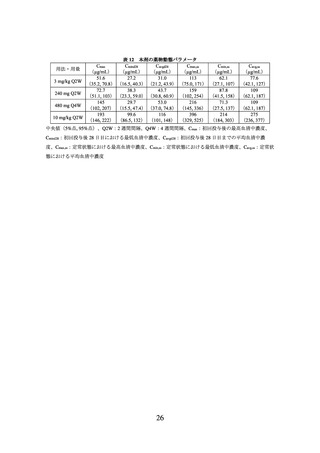
海外第Ⅲ相試験(CA209017試験及びCA209057試験)に組み入れられた患者のうち、
腫瘍組織においてPD-L1を発現した腫瘍細胞が占める割合(以下、
「PD-L1発現率」とい
う。
)に関する情報が得られた一部の患者のデータに基づき、PD-L1発現率別に探索的に
解析を行った有効性及び安全性の結果は以下のとおりであった。
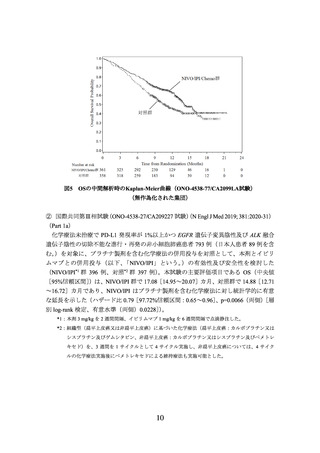
有効性に関しては、扁平上皮癌では、PD-L1の発現率によらず、ドセタキセル群と比
較して本剤群でOSが延長する傾向が認められた。
非扁平上皮癌では、PD-L1発現率が1%未満の場合にドセタキセル群とほぼ同様の結果
であった(下図)
。
なお、扁平上皮癌、非扁平上皮癌ともに、PD-L1の発現率によらず、本剤の安全性プ
ロファイルは同様であった。
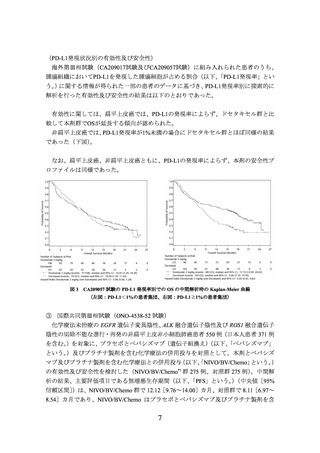
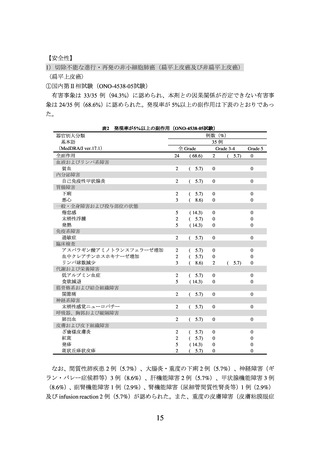
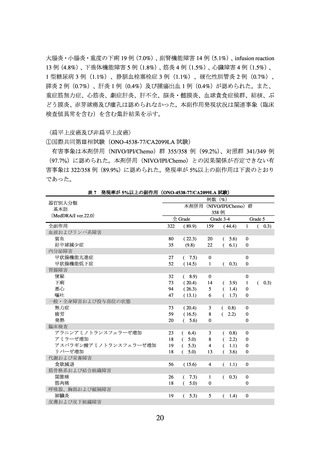
図3
CA209057 試験の PD-L1 発現率別での OS の中間解析時の Kaplan-Meier 曲線
(左図:PD-L1<1%の患者集団、右図:PD-L1≧1%の患者集団)
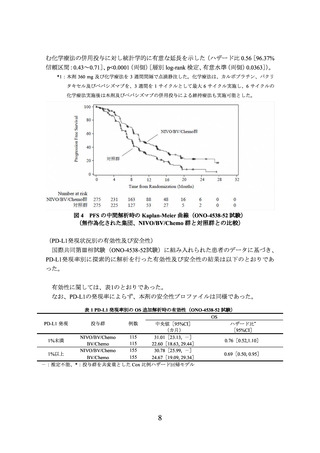
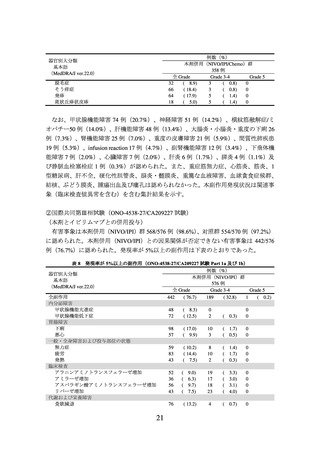
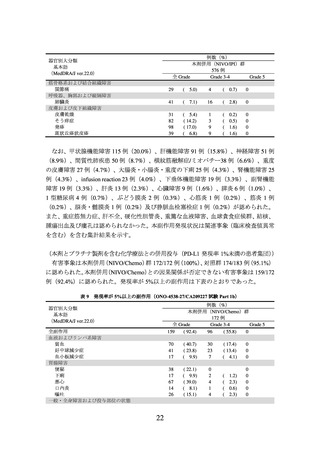
③ 国際共同第Ⅲ相試験(ONO-4538-52 試験)
化学療法未治療の EGFR 遺伝子変異陰性、ALK 融合遺伝子陰性及び ROS1 融合遺伝子
陰性の切除不能な進行・再発の非扁平上皮非小細胞肺癌患者 550 例(日本人患者 371 例
を含む。)を対象に、プラセボとベバシズマブ(遺伝子組換え)
(以下、
「ベバシズマブ」
という。)及びプラチナ製剤を含む化学療法の併用投与を対照として、本剤とベバシズ
マブ及びプラチナ製剤を含む化学療法との併用投与(以下、
「NIVO/BV/Chemo」という。)
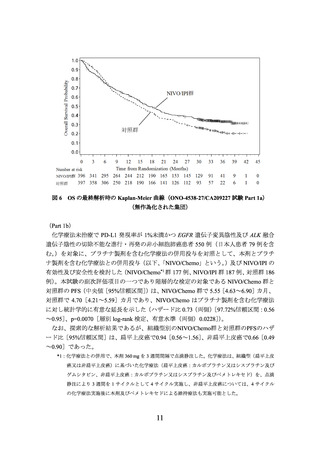
の有効性及び安全性を検討した(NIVO/BV/Chemo*1 群 275 例、対照群 275 例)
。中間解
析の結果、主要評価項目である無増悪生存期間(以下、
「PFS」という。)
(中央値[95%
信頼区間]
)は、NIVO/BV/Chemo 群で 12.12[9.76~14.00]カ月、対照群で 8.11[6.97~
8.54]カ月であり、NIVO/BV/Chemo はプラセボとベバシズマブ及びプラチナ製剤を含
7
海外第Ⅲ相試験(CA209017試験及びCA209057試験)に組み入れられた患者のうち、
腫瘍組織においてPD-L1を発現した腫瘍細胞が占める割合(以下、
「PD-L1発現率」とい
う。
)に関する情報が得られた一部の患者のデータに基づき、PD-L1発現率別に探索的に
解析を行った有効性及び安全性の結果は以下のとおりであった。
有効性に関しては、扁平上皮癌では、PD-L1の発現率によらず、ドセタキセル群と比
較して本剤群でOSが延長する傾向が認められた。
非扁平上皮癌では、PD-L1発現率が1%未満の場合にドセタキセル群とほぼ同様の結果
であった(下図)
。
なお、扁平上皮癌、非扁平上皮癌ともに、PD-L1の発現率によらず、本剤の安全性プ
ロファイルは同様であった。
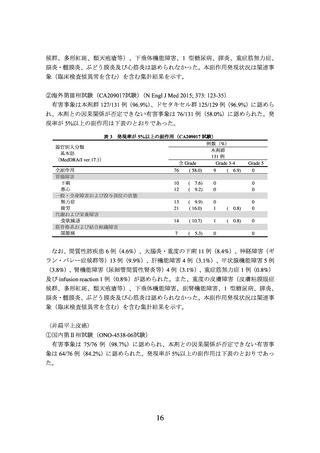
図3
CA209057 試験の PD-L1 発現率別での OS の中間解析時の Kaplan-Meier 曲線
(左図:PD-L1<1%の患者集団、右図:PD-L1≧1%の患者集団)
③ 国際共同第Ⅲ相試験(ONO-4538-52 試験)
化学療法未治療の EGFR 遺伝子変異陰性、ALK 融合遺伝子陰性及び ROS1 融合遺伝子
陰性の切除不能な進行・再発の非扁平上皮非小細胞肺癌患者 550 例(日本人患者 371 例
を含む。)を対象に、プラセボとベバシズマブ(遺伝子組換え)
(以下、
「ベバシズマブ」
という。)及びプラチナ製剤を含む化学療法の併用投与を対照として、本剤とベバシズ
マブ及びプラチナ製剤を含む化学療法との併用投与(以下、
「NIVO/BV/Chemo」という。)
の有効性及び安全性を検討した(NIVO/BV/Chemo*1 群 275 例、対照群 275 例)
。中間解
析の結果、主要評価項目である無増悪生存期間(以下、
「PFS」という。)
(中央値[95%
信頼区間]
)は、NIVO/BV/Chemo 群で 12.12[9.76~14.00]カ月、対照群で 8.11[6.97~
8.54]カ月であり、NIVO/BV/Chemo はプラセボとベバシズマブ及びプラチナ製剤を含
7