よむ、つかう、まなぶ。
総-2参考1○最適使用推進ガイドラインについて (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00190.html |
| 出典情報 | 中央社会保険医療協議会 総会(第546回 6/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
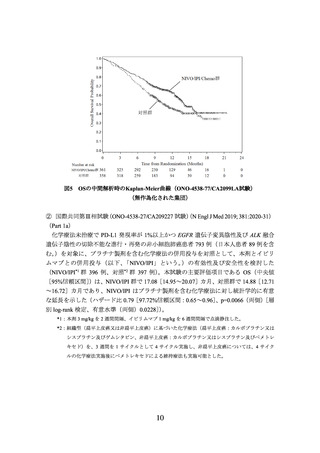
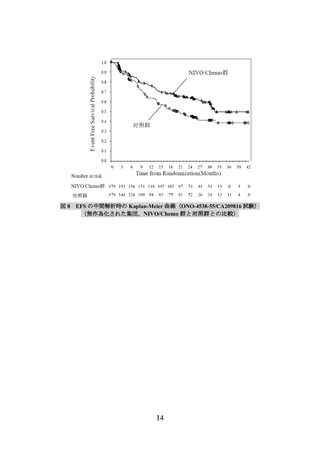
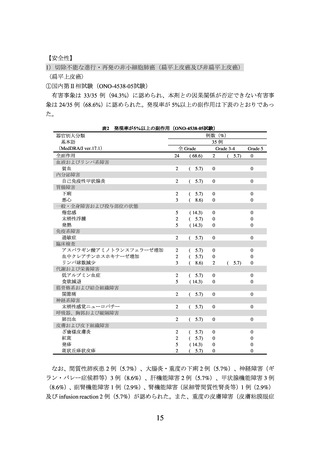
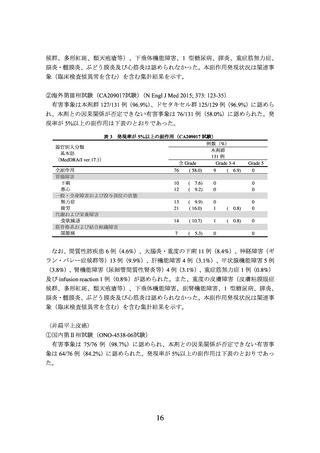
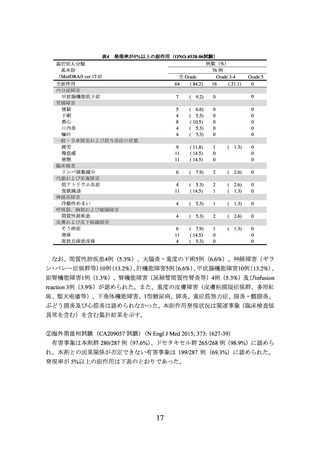
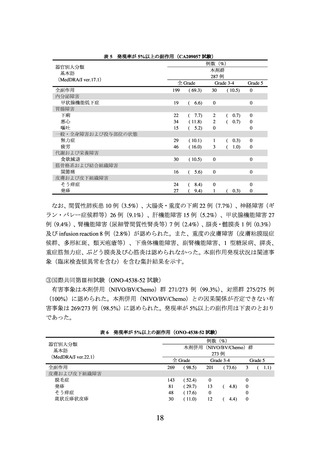
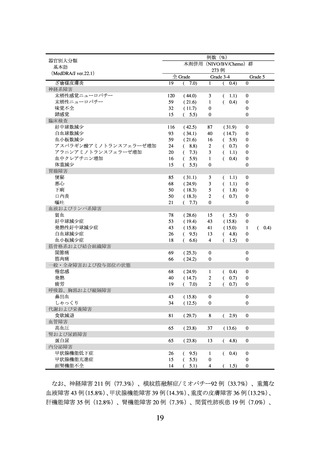
2)非小細胞肺癌における術前補助療法
① 国際共同第Ⅲ相試験(ONO-4538-55/CA209816 試験)(N Engl J Med 2022; 386: 197385)
臨床病期ⅠB(腫瘍径が 4 cm 以上)、Ⅱ又はⅢA の非小細胞肺癌の術前患者*1 358 例
(日本人患者 68 例を含む。
)を対象に、プラチナ製剤を含む化学療法の併用投与を対照
として、本剤とプラチナ製剤を含む化学療法との併用投与(以下、
「NIVO/Chemo」とい
う。)の有効性及び安全性を検討した(NIVO/Chemo*2 群 179 例、対照*3 群 179 例)
。中間
解析の結果、主要評価項目の一つである無イベント生存期間(以下、「EFS」という。)
(中央値[95%信頼区間]
)は、NIVO/Chemo 群で 31.57[30.16~推定不能]カ月、対照
群で 20.80[14.03~26.71]カ月であり、NIVO/Chemo はプラチナ製剤を含む化学療法の
併用投与に対し統計学的に有意な延長を示した(ハザード比 0.63(両側)
[97.38%信頼
区間:0.43~0.91]、p=0.0052[層別 log-rank 検定、有意水準(両側)0.0262]
)
。
*1:臨床病期は American Joint Committee on Cancer(AJCC)/Union for International Cancer Control(UICC)
病期分類(第 7 版)に基づく。
EGFR 遺伝子変異陽性又は ALK 融合遺伝子陽性であることが確認されている患者は対象外とした。
*2:化学療法との併用で、本剤 360 mg を 3 週間間隔で最大 3 サイクル点滴静注した。化学療法は、
組織型(扁平上皮癌又は非扁平上皮癌)に基づいた化学療法(扁平上皮癌:シスプラチン及びゲ
ムシタビン、又はカルボプラチン及びパクリタキセル、非扁平上皮癌:シスプラチン及びペメト
レキセド、又はカルボプラチン及びパクリタキセル)を、点滴静注により 3 週間間隔で最大 3 サ
イクル実施した。シスプラチンに対する忍容性がないと判断された場合には、カルボプラチンに
変更可能とした。
*3:組織型(扁平上皮癌又は非扁平上皮癌)に基づいた化学療法(扁平上皮癌:シスプラチン及びゲ
ムシタビン、シスプラチン及びビノレルビン、シスプラチン及びドセタキセル、又はカルボプラ
チン及びパクリタキセル、非扁平上皮癌:シスプラチン及びペメトレキセド、シスプラチン及び
ビノレルビン、シスプラチン及びドセタキセル、又はカルボプラチン及びパクリタキセル)を点
滴静注により 3 週間間隔で最大 3 サイクル実施した。シスプラチンに対する忍容性がないと判断
された場合には、カルボプラチンに変更可能とした。
13
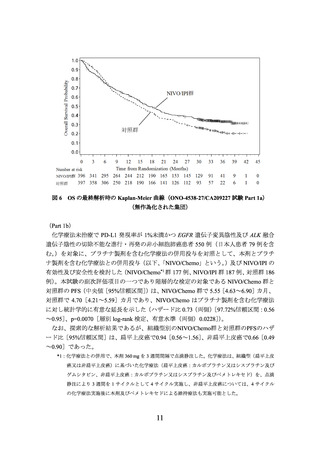
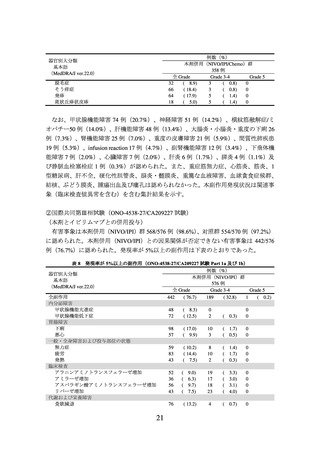
① 国際共同第Ⅲ相試験(ONO-4538-55/CA209816 試験)(N Engl J Med 2022; 386: 197385)
臨床病期ⅠB(腫瘍径が 4 cm 以上)、Ⅱ又はⅢA の非小細胞肺癌の術前患者*1 358 例
(日本人患者 68 例を含む。
)を対象に、プラチナ製剤を含む化学療法の併用投与を対照
として、本剤とプラチナ製剤を含む化学療法との併用投与(以下、
「NIVO/Chemo」とい
う。)の有効性及び安全性を検討した(NIVO/Chemo*2 群 179 例、対照*3 群 179 例)
。中間
解析の結果、主要評価項目の一つである無イベント生存期間(以下、「EFS」という。)
(中央値[95%信頼区間]
)は、NIVO/Chemo 群で 31.57[30.16~推定不能]カ月、対照
群で 20.80[14.03~26.71]カ月であり、NIVO/Chemo はプラチナ製剤を含む化学療法の
併用投与に対し統計学的に有意な延長を示した(ハザード比 0.63(両側)
[97.38%信頼
区間:0.43~0.91]、p=0.0052[層別 log-rank 検定、有意水準(両側)0.0262]
)
。
*1:臨床病期は American Joint Committee on Cancer(AJCC)/Union for International Cancer Control(UICC)
病期分類(第 7 版)に基づく。
EGFR 遺伝子変異陽性又は ALK 融合遺伝子陽性であることが確認されている患者は対象外とした。
*2:化学療法との併用で、本剤 360 mg を 3 週間間隔で最大 3 サイクル点滴静注した。化学療法は、
組織型(扁平上皮癌又は非扁平上皮癌)に基づいた化学療法(扁平上皮癌:シスプラチン及びゲ
ムシタビン、又はカルボプラチン及びパクリタキセル、非扁平上皮癌:シスプラチン及びペメト
レキセド、又はカルボプラチン及びパクリタキセル)を、点滴静注により 3 週間間隔で最大 3 サ
イクル実施した。シスプラチンに対する忍容性がないと判断された場合には、カルボプラチンに
変更可能とした。
*3:組織型(扁平上皮癌又は非扁平上皮癌)に基づいた化学療法(扁平上皮癌:シスプラチン及びゲ
ムシタビン、シスプラチン及びビノレルビン、シスプラチン及びドセタキセル、又はカルボプラ
チン及びパクリタキセル、非扁平上皮癌:シスプラチン及びペメトレキセド、シスプラチン及び
ビノレルビン、シスプラチン及びドセタキセル、又はカルボプラチン及びパクリタキセル)を点
滴静注により 3 週間間隔で最大 3 サイクル実施した。シスプラチンに対する忍容性がないと判断
された場合には、カルボプラチンに変更可能とした。
13