よむ、つかう、まなぶ。
【資料1】積み残しの論点等について (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32480.html |
| 出典情報 | 医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会(第11回 4/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
患者団体ヒアリング結果
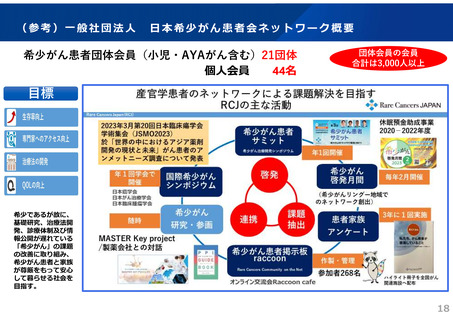
一般社団法人 日本希少がん患者会ネットワーク(1/2)
ドラッグラグ・ドラッグロス(国内未承認薬)に関しての課題感
海外でオーファン、ファストトラック、ブレークスルーセラピーの指定を受けている品目であって、日本
国内では開発情報がない未承認薬の割合が増加していることを危惧している。国際共同治験が日本で実施
されないケースが顕在化し、結果として、外国で使用可能な薬が日本で使えない。
•
その主な要因は以下3点あると考えている。
①薬価制度の問題。開発の主体となっている新興バイオファーマは投資回収を早くしたいと考えているが、
日本は海外よりも低くなってしまうと聞いている。薬価の予見可能性が低いことや改定により薬価が下
がることも要因だと思う。
②薬事制度の問題。日本人データが必要とされることや、日本語対応が必要であることも手間であると聞
いている。また、オーファンドラッグ指定制度があるが、アメリカでは日本の10倍もの品目が対象に
なっている。制度が使いづらいのではないか。
③疾患毎の患者数が分からないこと。患者数を調べて海外にオープンにすることで解消が図られるのでは
ないか。
• また、患者会は大手製薬メーカとの付き合いはあるが、新興バイオファーマとは繋がりがなく、情報がは
いってこない。
• 被験者リクルーティングについて、治験の情報を公開することは重要。日本はjRCT(厚生労働省が作成
している臨床研究等の公開システム)があるが、分かりづらい。このほか、治験に参加する被験者からは、
交通費が負担となっているといったことも聞いている。分散型治験が希少がんにも広がってくれることを
期待している。また、治験実施に当たってパネル検査が必要だがこれが高額(20万円程度)であること
も、治験参加を躊躇う要因の一つである。
• 「医療上の必要性の高い未承認薬・適応外薬検討会議」について、要件のうち「欧米ガイドラインに記載
されているもの」を満たすものは、海外だとジェネリック医薬品に該当するようなもの。誰も手を付けて
いない医薬品を使えるようにできるシステムが、日本にはない。また、日本でそもそも使用例がないため、
公知申請もできない。志の高い医師が自らデータを集めて申請してもらっている状況。
•
16
一般社団法人 日本希少がん患者会ネットワーク(1/2)
ドラッグラグ・ドラッグロス(国内未承認薬)に関しての課題感
海外でオーファン、ファストトラック、ブレークスルーセラピーの指定を受けている品目であって、日本
国内では開発情報がない未承認薬の割合が増加していることを危惧している。国際共同治験が日本で実施
されないケースが顕在化し、結果として、外国で使用可能な薬が日本で使えない。
•
その主な要因は以下3点あると考えている。
①薬価制度の問題。開発の主体となっている新興バイオファーマは投資回収を早くしたいと考えているが、
日本は海外よりも低くなってしまうと聞いている。薬価の予見可能性が低いことや改定により薬価が下
がることも要因だと思う。
②薬事制度の問題。日本人データが必要とされることや、日本語対応が必要であることも手間であると聞
いている。また、オーファンドラッグ指定制度があるが、アメリカでは日本の10倍もの品目が対象に
なっている。制度が使いづらいのではないか。
③疾患毎の患者数が分からないこと。患者数を調べて海外にオープンにすることで解消が図られるのでは
ないか。
• また、患者会は大手製薬メーカとの付き合いはあるが、新興バイオファーマとは繋がりがなく、情報がは
いってこない。
• 被験者リクルーティングについて、治験の情報を公開することは重要。日本はjRCT(厚生労働省が作成
している臨床研究等の公開システム)があるが、分かりづらい。このほか、治験に参加する被験者からは、
交通費が負担となっているといったことも聞いている。分散型治験が希少がんにも広がってくれることを
期待している。また、治験実施に当たってパネル検査が必要だがこれが高額(20万円程度)であること
も、治験参加を躊躇う要因の一つである。
• 「医療上の必要性の高い未承認薬・適応外薬検討会議」について、要件のうち「欧米ガイドラインに記載
されているもの」を満たすものは、海外だとジェネリック医薬品に該当するようなもの。誰も手を付けて
いない医薬品を使えるようにできるシステムが、日本にはない。また、日本でそもそも使用例がないため、
公知申請もできない。志の高い医師が自らデータを集めて申請してもらっている状況。
•
16