よむ、つかう、まなぶ。
資料1-1 早期導入を要望する医療機器(放射性ビーズ(No. 2016-2))の品目追加に関する要望書 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32363.html |
| 出典情報 | 医療ニーズの高い医療機器等の早期導入に関する検討会(第35回 3/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
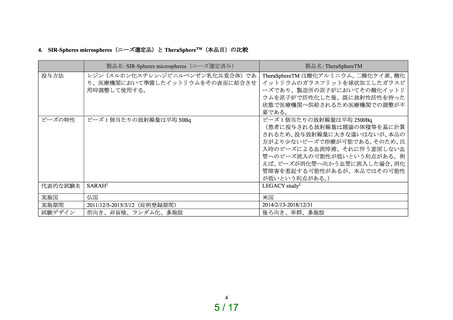
<補足2>(LEGACY study を含めた)癌種別の TheraSphereTM を用いた代表的な臨床試験の成績について
①肝細胞癌
書誌事項
Salem R, Johnson GE, Kim E, Riaz A, Bishay V, Boucher E, et al. Yttrium-90 Radioembolization for the Treatment of Solitary, Unresectable
HCC: The LEGACY Study.2
使用機器
試験・研究デザイン
対象
TheraSphereTM
目的
後ろ向き、単群、多施設
切除不能な孤立性肝細胞がん患者において本治療法の局所腫瘍コントロールと効果持続期間を評価。本試験に参加した 3 施
設で 2014/2/13 から 2017/12/22 の間に本品による治療を受けた 162 例
本試験は FDA の PMA 承認のため実施された。上記対象における本品の有効性・安全性を評価。主要評価項目は以下の複合
エンドポイントの達成率とした。
Localized mRECIST 評価による ORR(奏効率)が 40%以上であること
効果がみられた患者の 60%以上において Localized mRECIST 評価による DOR(効果持続期間)が 6 ヵ月以上であること
副次的評価として RECIST1.1、mRECIST による評価、有害事象の収集も行った。
結果
(注)RECIST 1.1 は腫瘍縮小効果を評価する上で一般的に用いられる評価手法である。mRECIST(modified RECIST)は造影
剤による腫瘍濃染を評価することで、特に肝細胞癌において多くみられる腫瘍の縮小を伴わない細胞壊死効果を確認するた
めに用いられる。なお、RECIST は通常、全身の腫瘍のうち、大きなものから順に最大 5 個が評価対象として選択されるが、
本品は肝内病変の治療を目的としているため肝内に限局(Localized)した評価を主要評価項目として設定している。
Localized mRECIST 評価による ORR は 72.2%(95%CI: 64.9, 78.5)であった
Localized mRECIST 評価による DOR は効果がみられた患者の 76.1%(95%CI: 67.6, 82.9)で 6 ヵ月以上であった
上記より本試験の主要評価項目は達成された。
RECIST 1.1 評価における ORR は 46.3%(95%CI: 38.8, 54.0)
、DOR は効果がみられた患者の 72.0%(95%CI: 61.0, 80.9)で
6 ヵ月以上であった
mRECIST 評価における ORR は 68.5%(95%CI: 61.0, 75.2)
、DOR は効果がみられた患者の 74.8%(95%CI: 66.0, 81.9)で
6 ヵ月以上であった
CTCAE における Grade 3 以上のイベントが 31 例(19.1%)で確認された(貧血 1、消化管障害 7、疲労 1、発熱 1、腹水
3、胆管閉塞 1、門脈塞栓症 1、感染 4、ビリルビン上昇 3、INR 上昇 2、リンパ球数減少 12、血小板数減少 1、白血球数
減少 1、高アルブミン血症 1、筋骨格系障害 2、神経系障害 1、呼吸困難 1、肺塞栓症 1)
。Grade4(血小板数の悪化)
、Grade5
(脳神経系障害)が 1 例ずつ発現したが、いずれも手技/機器と関連のないものであった。
重篤な有害事象は 16 例(9.9%)で発現し、うち、9 例(5.6%)が手技/機器との関連が否定できないものであった。また、
8
9 / 17
①肝細胞癌
書誌事項
Salem R, Johnson GE, Kim E, Riaz A, Bishay V, Boucher E, et al. Yttrium-90 Radioembolization for the Treatment of Solitary, Unresectable
HCC: The LEGACY Study.2
使用機器
試験・研究デザイン
対象
TheraSphereTM
目的
後ろ向き、単群、多施設
切除不能な孤立性肝細胞がん患者において本治療法の局所腫瘍コントロールと効果持続期間を評価。本試験に参加した 3 施
設で 2014/2/13 から 2017/12/22 の間に本品による治療を受けた 162 例
本試験は FDA の PMA 承認のため実施された。上記対象における本品の有効性・安全性を評価。主要評価項目は以下の複合
エンドポイントの達成率とした。
Localized mRECIST 評価による ORR(奏効率)が 40%以上であること
効果がみられた患者の 60%以上において Localized mRECIST 評価による DOR(効果持続期間)が 6 ヵ月以上であること
副次的評価として RECIST1.1、mRECIST による評価、有害事象の収集も行った。
結果
(注)RECIST 1.1 は腫瘍縮小効果を評価する上で一般的に用いられる評価手法である。mRECIST(modified RECIST)は造影
剤による腫瘍濃染を評価することで、特に肝細胞癌において多くみられる腫瘍の縮小を伴わない細胞壊死効果を確認するた
めに用いられる。なお、RECIST は通常、全身の腫瘍のうち、大きなものから順に最大 5 個が評価対象として選択されるが、
本品は肝内病変の治療を目的としているため肝内に限局(Localized)した評価を主要評価項目として設定している。
Localized mRECIST 評価による ORR は 72.2%(95%CI: 64.9, 78.5)であった
Localized mRECIST 評価による DOR は効果がみられた患者の 76.1%(95%CI: 67.6, 82.9)で 6 ヵ月以上であった
上記より本試験の主要評価項目は達成された。
RECIST 1.1 評価における ORR は 46.3%(95%CI: 38.8, 54.0)
、DOR は効果がみられた患者の 72.0%(95%CI: 61.0, 80.9)で
6 ヵ月以上であった
mRECIST 評価における ORR は 68.5%(95%CI: 61.0, 75.2)
、DOR は効果がみられた患者の 74.8%(95%CI: 66.0, 81.9)で
6 ヵ月以上であった
CTCAE における Grade 3 以上のイベントが 31 例(19.1%)で確認された(貧血 1、消化管障害 7、疲労 1、発熱 1、腹水
3、胆管閉塞 1、門脈塞栓症 1、感染 4、ビリルビン上昇 3、INR 上昇 2、リンパ球数減少 12、血小板数減少 1、白血球数
減少 1、高アルブミン血症 1、筋骨格系障害 2、神経系障害 1、呼吸困難 1、肺塞栓症 1)
。Grade4(血小板数の悪化)
、Grade5
(脳神経系障害)が 1 例ずつ発現したが、いずれも手技/機器と関連のないものであった。
重篤な有害事象は 16 例(9.9%)で発現し、うち、9 例(5.6%)が手技/機器との関連が否定できないものであった。また、
8
9 / 17