よむ、つかう、まなぶ。
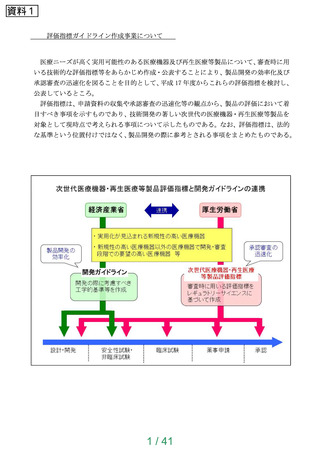
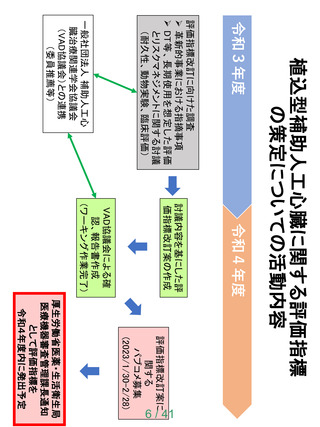
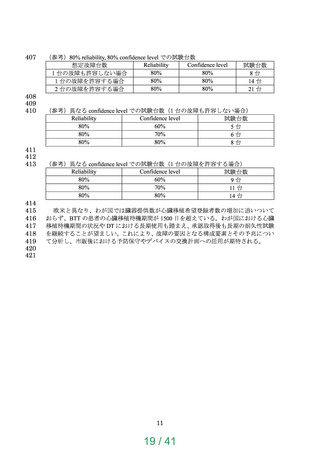
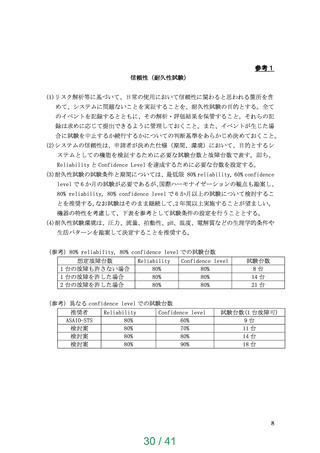
【資料1】次世代医療機器評価指標について (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32218.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第10回 3/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ついて示したものである。よって、今後の更なる技術革新や知見の集積等を踏まえ改訂
されるものであり、申請内容に関して拘束力を有するものではない。
人工心臓の評価にあたっては、個別の製品の特性を十分理解した上で、科学的な合理
性をもって柔軟に対応することが必要である。
なお、本評価指標の他、国内外のその他の関連ガイドラインを参考にすることも考慮
すべきである。
4.評価に当たって留意すべき事項
(1)基本的事項
・開発の経緯、品目仕様(システム全体のサイズ及び重量)、国内外での使用状況、
設計開発とシステムの原理、目標とされる使用方法等を明確に示す。また、考慮
すべきリスクと新たに期待できる効果について考察する。
・システム全体の安全性や患者の QOL が確保されているかという観点から以下の事
項に対する影響の可能性について示す。
a) 日常の行動:座位、立位、歩行、走行、転倒時
b) 移動環境:車などの振動、航空機などの気圧変化
c) 植込み機器、体外機器、ドライブラインなどの皮膚、臓器、器官の圧迫
d) 機器の騒音、振動
e) 荷重負担:バッテリー、駆動制御装置など
f) アラーム:種類、表示、一定時間の安全性の確保、患者教育
g) 環境:電磁波、低温など
(2)非臨床試験
臨床試験の開始に当たって、以下に示す in vitro 評価、in vivo 評価を通して、
システムの信頼性・耐久性、安全性、生物学的安全性等の評価を適切に行い、臨床
使用の妥当性を検討すること。
・In vitro 評価
以下の各事項についてそれぞれ具体的なデータをもって明らかにすること。
1) 血液ポンプ、カニューレ、人工弁、心房・心尖カフの性能、安全性、信頼性
a) 血液ポンプの性能と使用条件・目的との関係
b) 血液ポンプ内に血流の鬱滞部やキャビテーションの発生箇所の有無
c) 血液ポンプとカニューレや人工弁との接続部のリング状血栓対策、固定方
法などの安全対策
d) 信頼性を確保するための具体的な対策
2)駆動制御装置(モータ、電磁石等を含む)の性能、安全性、信頼性
2
24 / 41
されるものであり、申請内容に関して拘束力を有するものではない。
人工心臓の評価にあたっては、個別の製品の特性を十分理解した上で、科学的な合理
性をもって柔軟に対応することが必要である。
なお、本評価指標の他、国内外のその他の関連ガイドラインを参考にすることも考慮
すべきである。
4.評価に当たって留意すべき事項
(1)基本的事項
・開発の経緯、品目仕様(システム全体のサイズ及び重量)、国内外での使用状況、
設計開発とシステムの原理、目標とされる使用方法等を明確に示す。また、考慮
すべきリスクと新たに期待できる効果について考察する。
・システム全体の安全性や患者の QOL が確保されているかという観点から以下の事
項に対する影響の可能性について示す。
a) 日常の行動:座位、立位、歩行、走行、転倒時
b) 移動環境:車などの振動、航空機などの気圧変化
c) 植込み機器、体外機器、ドライブラインなどの皮膚、臓器、器官の圧迫
d) 機器の騒音、振動
e) 荷重負担:バッテリー、駆動制御装置など
f) アラーム:種類、表示、一定時間の安全性の確保、患者教育
g) 環境:電磁波、低温など
(2)非臨床試験
臨床試験の開始に当たって、以下に示す in vitro 評価、in vivo 評価を通して、
システムの信頼性・耐久性、安全性、生物学的安全性等の評価を適切に行い、臨床
使用の妥当性を検討すること。
・In vitro 評価
以下の各事項についてそれぞれ具体的なデータをもって明らかにすること。
1) 血液ポンプ、カニューレ、人工弁、心房・心尖カフの性能、安全性、信頼性
a) 血液ポンプの性能と使用条件・目的との関係
b) 血液ポンプ内に血流の鬱滞部やキャビテーションの発生箇所の有無
c) 血液ポンプとカニューレや人工弁との接続部のリング状血栓対策、固定方
法などの安全対策
d) 信頼性を確保するための具体的な対策
2)駆動制御装置(モータ、電磁石等を含む)の性能、安全性、信頼性
2
24 / 41