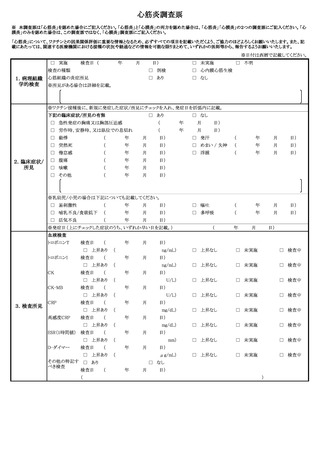
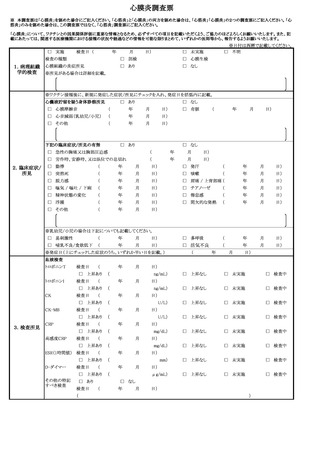
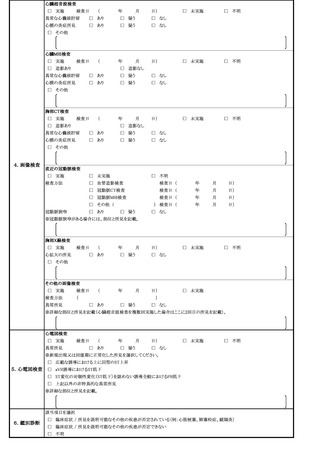
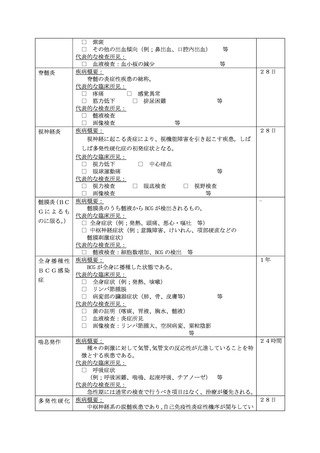
よむ、つかう、まなぶ。
参考資料14 定期の予防接種等による副反応疑いの報告等の取扱いについて(平成25年3月30日付け健発0330第3号・薬食発0330第1号厚生労働省健康局長及び医薬食品局長連名通知。最終改正:令和4年10月24日) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00059.html |
| 出典情報 | 第92回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第27回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考資料14
(参考 改正後全文)
平成25年3月30日
健 発 0330 第 3 号
薬 食 発 0330 第 1 号
各都道府県知事 殿
厚生労働省健康局長
(
公 印 省 略
)
厚生労働省医薬食品局長
(
公 印 省 略
)
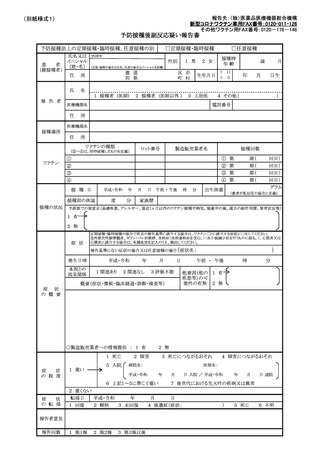
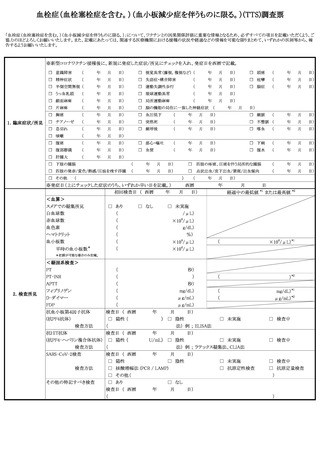
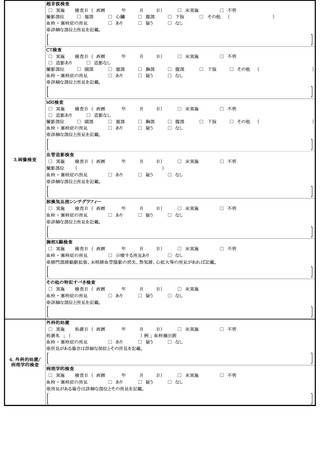
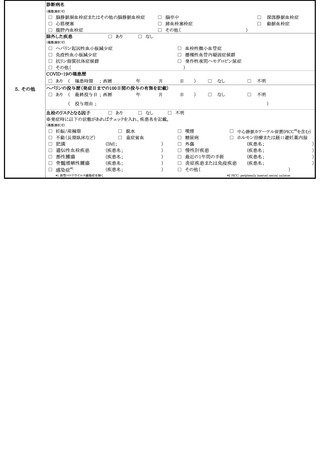
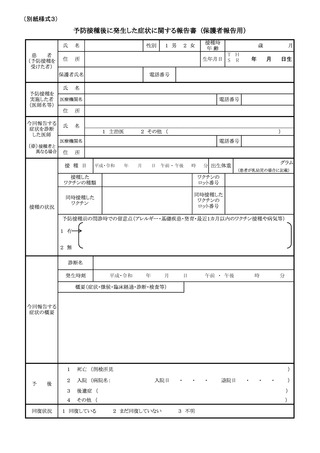
定期の予防接種等による副反応疑いの報告等の取扱いについて
予防接種法の一部を改正する法律(平成 25 年法律8号)が本日公布され、4月1日よ
り、病院若しくは診療所の開設者又は医師(以下「医師等」という。)は、定期の予防接
種又は臨時の予防接種(以下「定期の予防接種等」という。)を受けた者が、厚生労働大
臣が定める症状を呈していることを知ったときは、厚生労働大臣に報告することが義務付
けられたところである。また、併せて、予防接種法施行規則の一部を改正する省令(平成
25 年厚生労働省令第 50 号)も本日公布され、報告すべき症状等を定めたところである。
その後、薬事法等の一部を改正する法律(平成 25 年法律第 84 号)による予防接種法の
改正により、平成 26 年 11 月 25 日から、医師等は、独立行政法人医薬品医療機器総合機
構(以下「機構」という。)に氏名及び生年月日を含む副反応疑い報告(予防接種法(昭
和 23 年法律第 68 号)第 12 条第1項の規定による報告をいう。以下同じ。)を行うこと
とされた。
ついては、副反応疑い報告及び予防接種に係る医薬品、医療機器等の品質、有効性及び
安全性の確保等に関する法律(昭和 35 年法律第 145 号)第 68 条の 10 第2項の規定によ
る報告について、下記のとおり取り扱うこととしたので、貴管内市町村及び関係機関等に
対する周知を図るとともに、その実施に遺漏なきを期されたい。
なお、公益社団法人日本医師会等に対し、本件に係る協力を依頼していることを申し添
える。
(参考 改正後全文)
平成25年3月30日
健 発 0330 第 3 号
薬 食 発 0330 第 1 号
各都道府県知事 殿
厚生労働省健康局長
(
公 印 省 略
)
厚生労働省医薬食品局長
(
公 印 省 略
)
定期の予防接種等による副反応疑いの報告等の取扱いについて
予防接種法の一部を改正する法律(平成 25 年法律8号)が本日公布され、4月1日よ
り、病院若しくは診療所の開設者又は医師(以下「医師等」という。)は、定期の予防接
種又は臨時の予防接種(以下「定期の予防接種等」という。)を受けた者が、厚生労働大
臣が定める症状を呈していることを知ったときは、厚生労働大臣に報告することが義務付
けられたところである。また、併せて、予防接種法施行規則の一部を改正する省令(平成
25 年厚生労働省令第 50 号)も本日公布され、報告すべき症状等を定めたところである。
その後、薬事法等の一部を改正する法律(平成 25 年法律第 84 号)による予防接種法の
改正により、平成 26 年 11 月 25 日から、医師等は、独立行政法人医薬品医療機器総合機
構(以下「機構」という。)に氏名及び生年月日を含む副反応疑い報告(予防接種法(昭
和 23 年法律第 68 号)第 12 条第1項の規定による報告をいう。以下同じ。)を行うこと
とされた。
ついては、副反応疑い報告及び予防接種に係る医薬品、医療機器等の品質、有効性及び
安全性の確保等に関する法律(昭和 35 年法律第 145 号)第 68 条の 10 第2項の規定によ
る報告について、下記のとおり取り扱うこととしたので、貴管内市町村及び関係機関等に
対する周知を図るとともに、その実施に遺漏なきを期されたい。
なお、公益社団法人日本医師会等に対し、本件に係る協力を依頼していることを申し添
える。