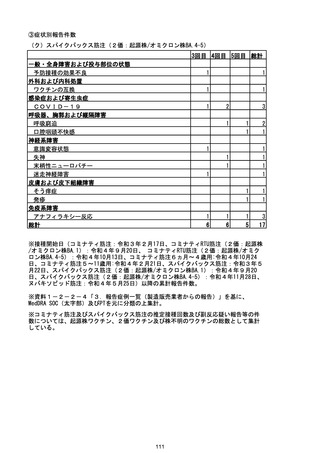
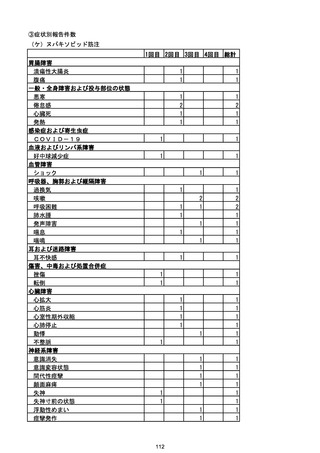
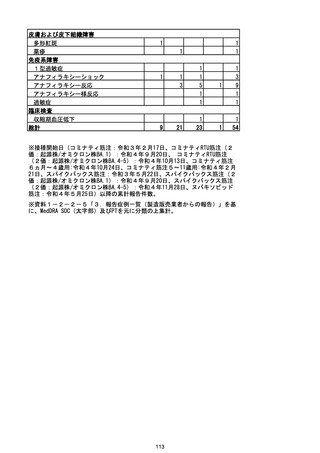
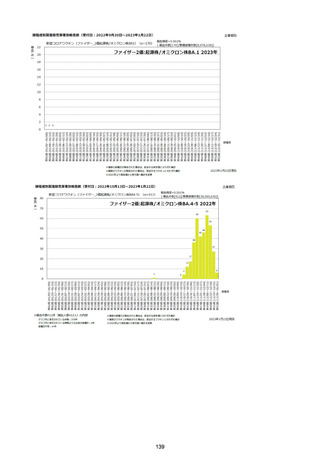
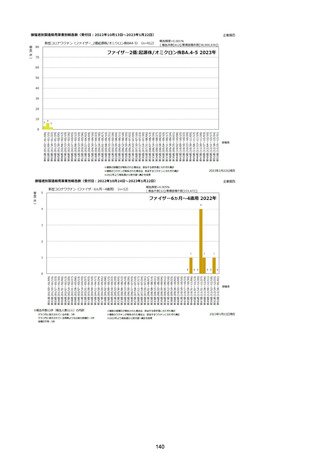
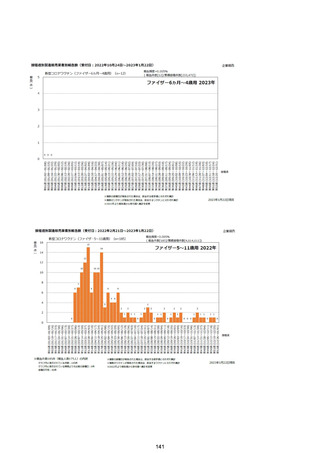
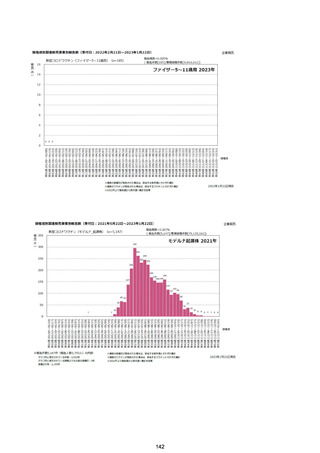
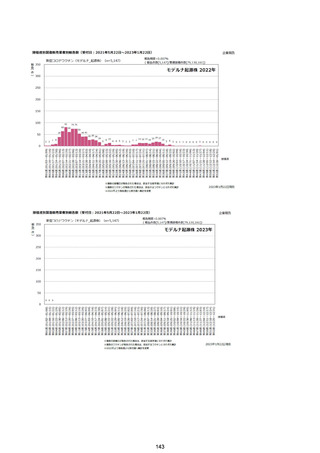
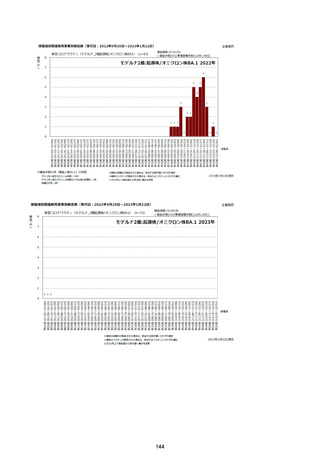
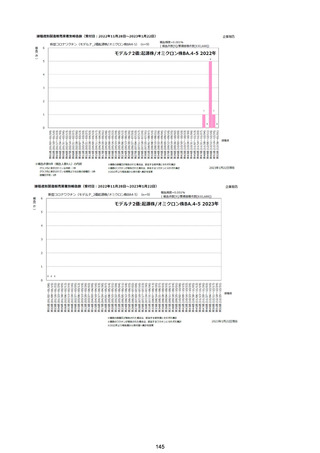
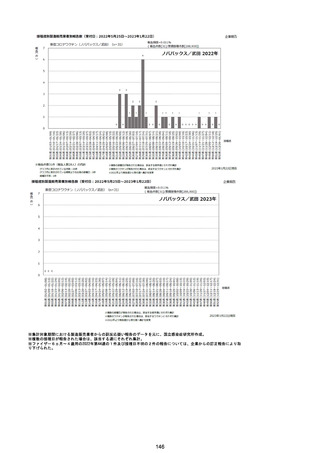
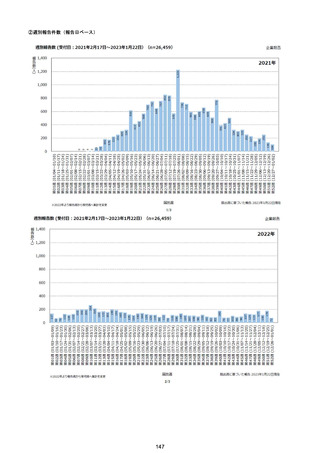
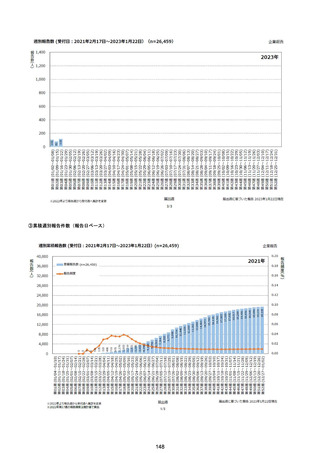
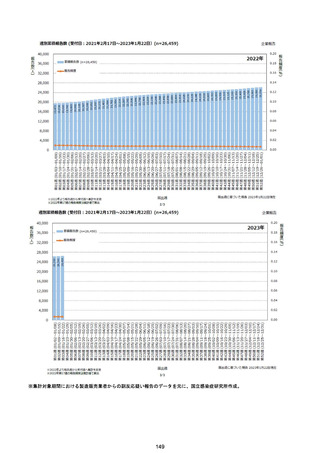
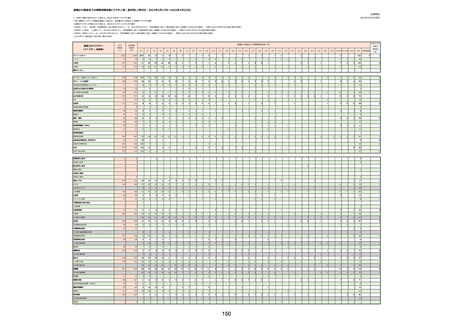
資料1-2-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について (128 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00059.html |
| 出典情報 | 第92回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第27回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(3/10)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
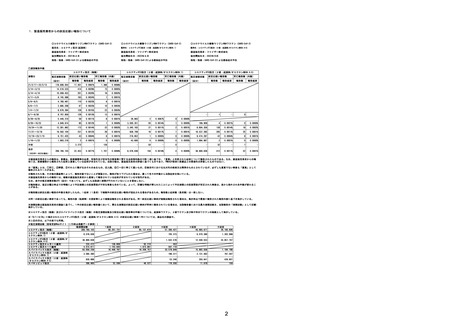
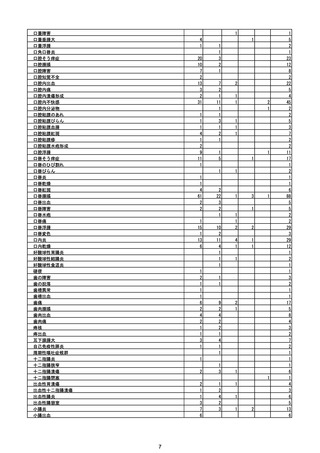
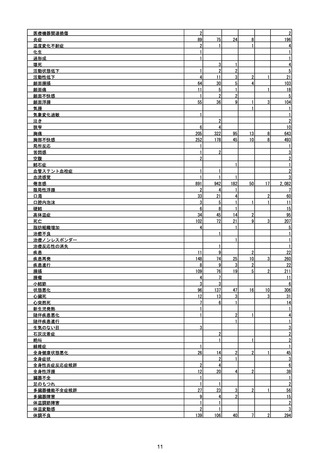
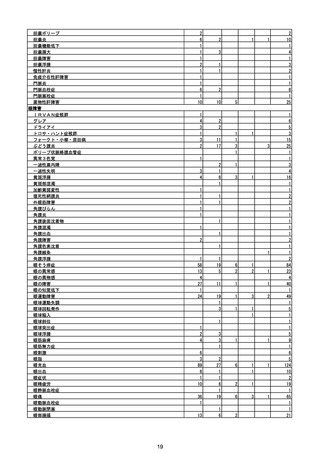
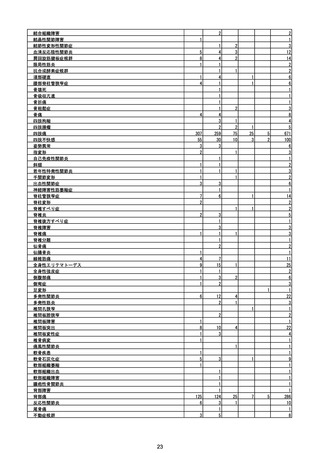
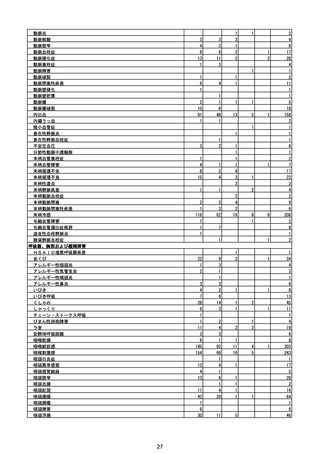
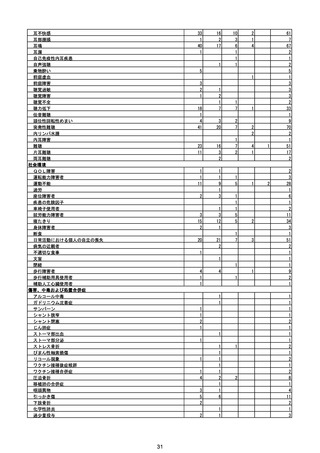
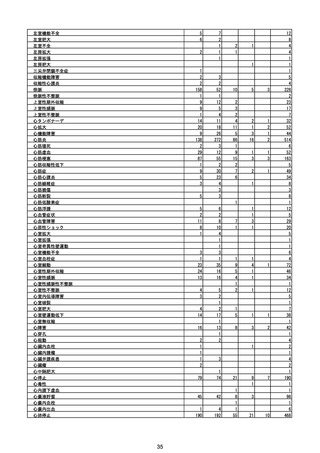
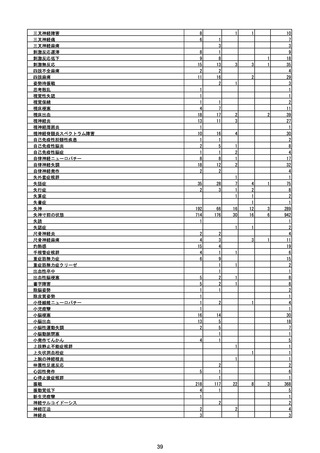
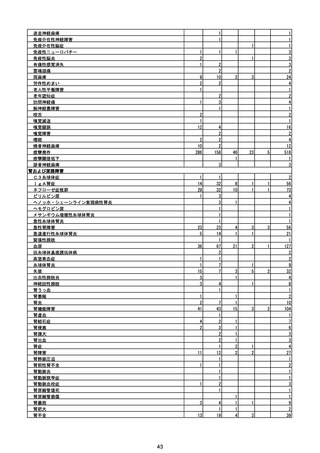
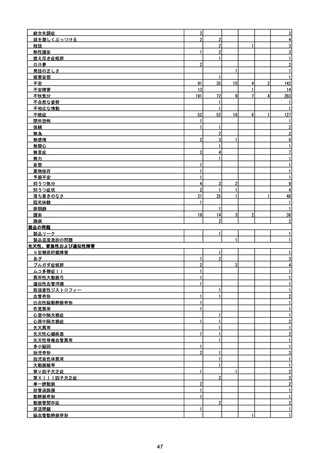
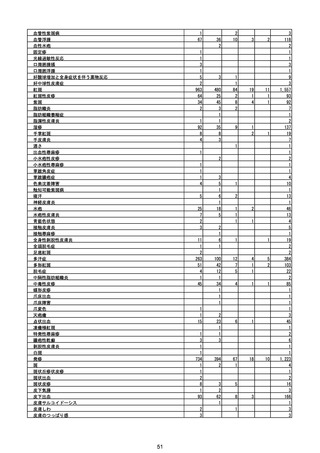
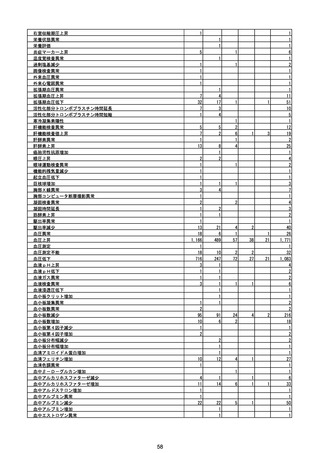
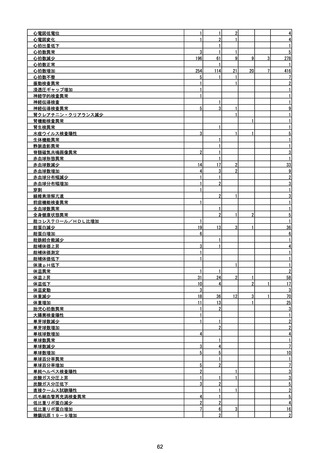
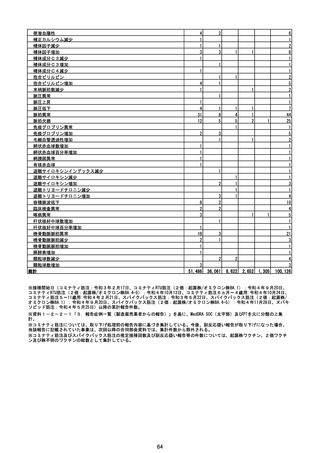
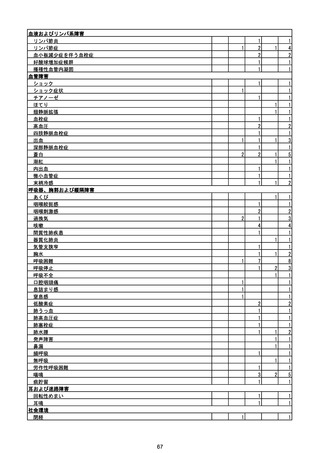
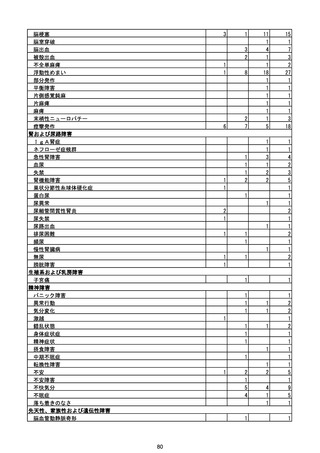
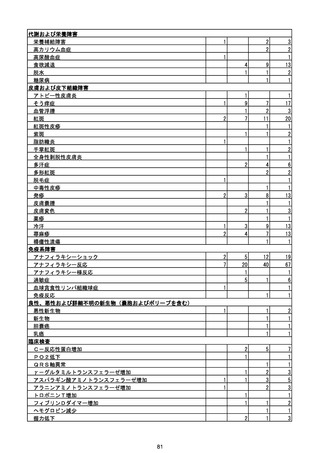
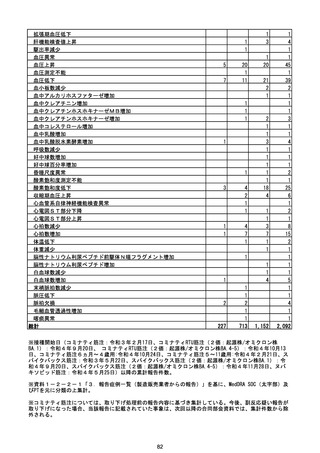
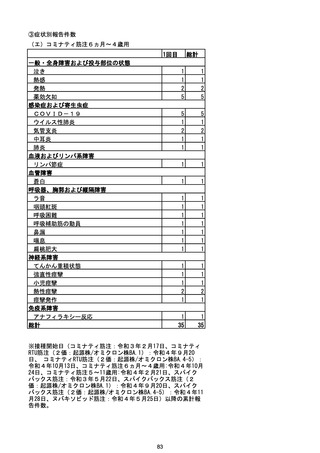
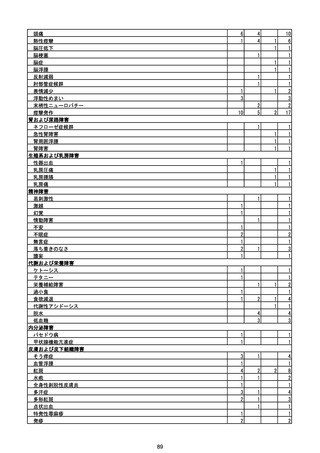
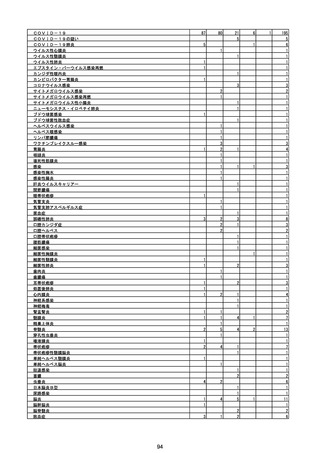
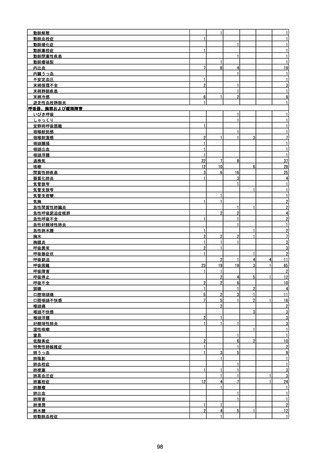
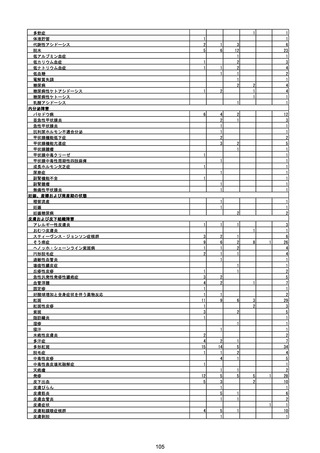
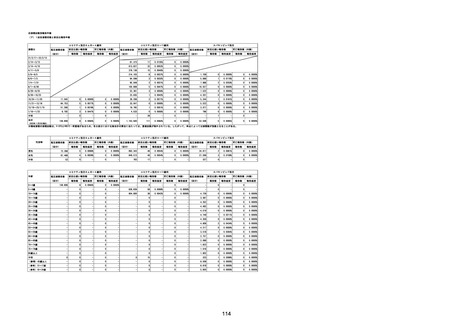
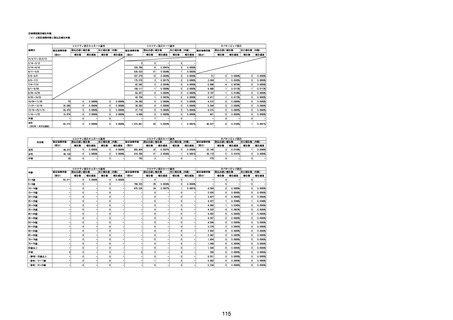
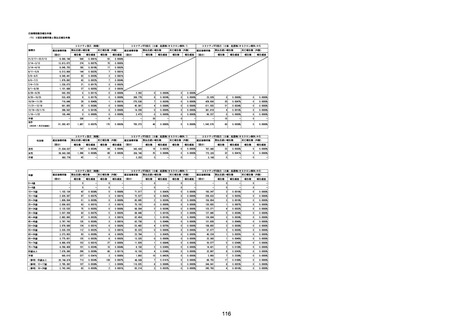
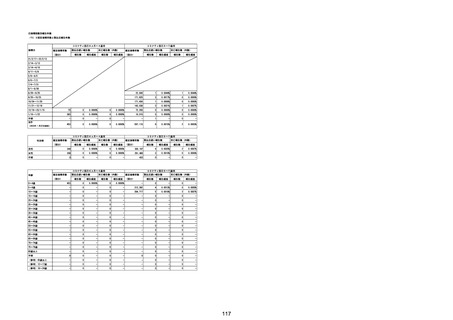
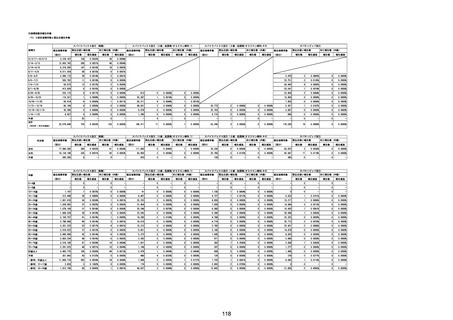
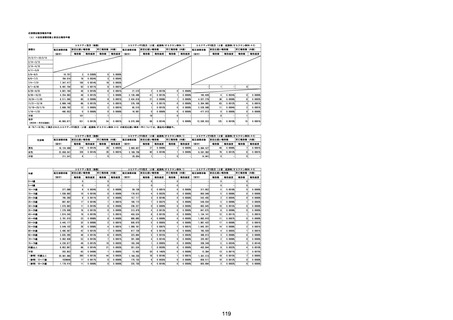
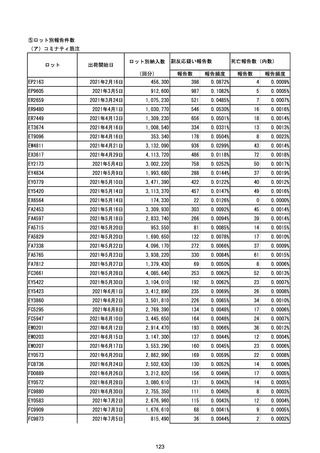
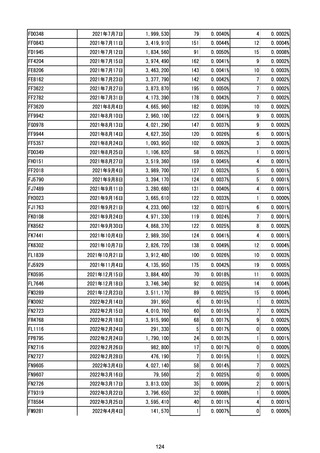
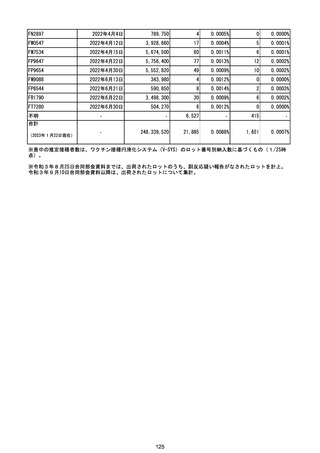
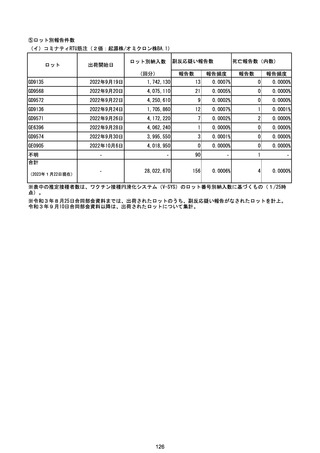
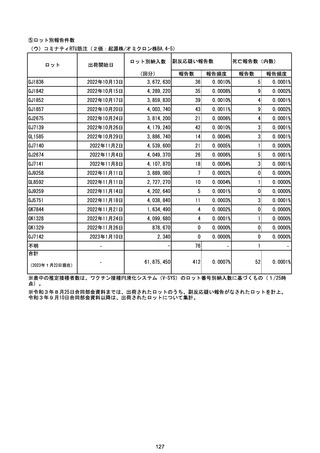
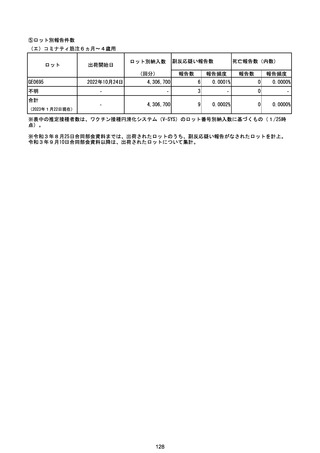
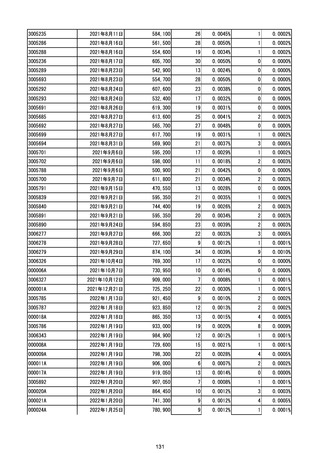
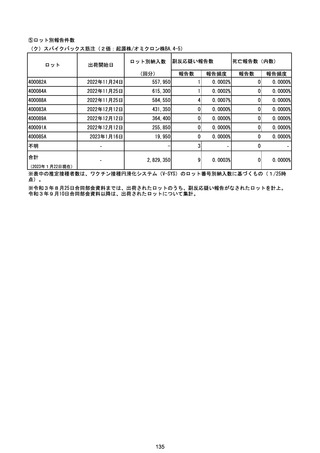
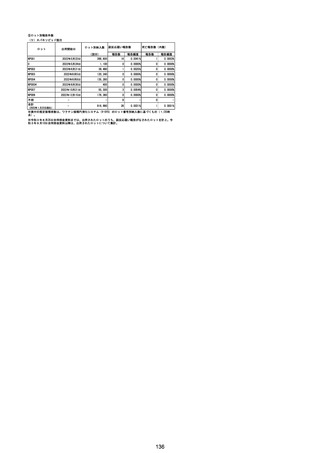
(エ)コミナティ筋注6ヵ月~4歳用
ロット
出荷開始日
ロット別納入数
(回分)
GE0695
不明
合計
2022年10月24日
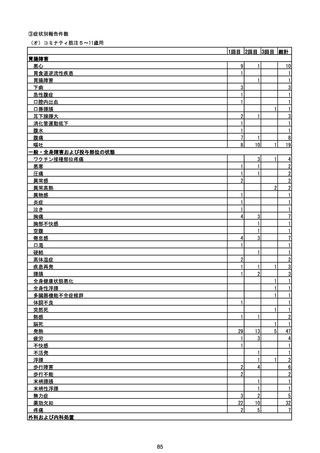
副反応疑い報告数
報告数
死亡報告数(内数)
報告頻度
報告数
報告頻度
4,306,700
6
0.0001%
0
0.0000%
‐
‐
3
‐
0
‐
‐
4,306,700
9
0.0002%
0
0.0000%
(2023年1月22日現在)
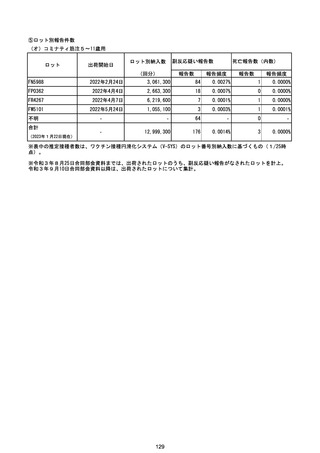
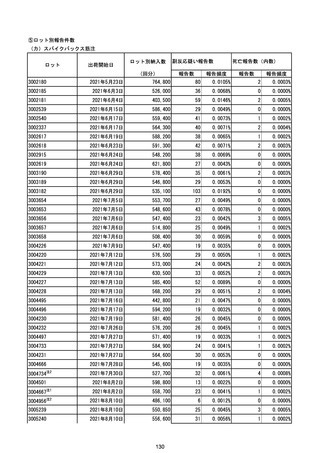
※表中の推定接種者数は、ワクチン接種円滑化システム(V-SYS)のロット番号別納入数に基づくもの(1/25時
点)。
※令和3年8月25日合同部会資料までは、出荷されたロットのうち、副反応疑い報告がなされたロットを計上。
令和3年9月10日合同部会資料以降は、出荷されたロットについて集計。
128