よむ、つかう、まなぶ。
総-5-4○最適使用推進ガイドラインについて (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00173.html |
| 出典情報 | 中央社会保険医療協議会 総会(第536回 1/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
個/kg)を 30 分以内に単回静脈内投与することとされた。
また、生体内での本品の生着及び増殖を促進することを目的として、本品投与の 5 日前か
ら 3 日間連続で前処置として以下の LD 化学療法を行うこととされた。なお、本品製造期間
中(試験への登録から LD 化学療法前まで)に、患者の状態に応じ副腎皮質ステロイド投与
が許容され、本品投与 5 日前までに完了することとされた。
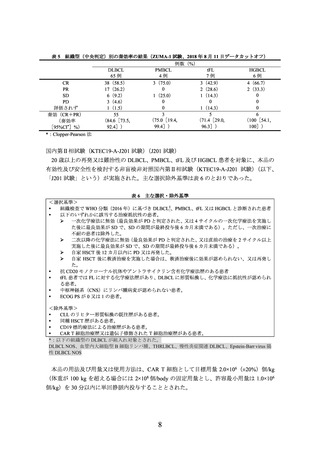
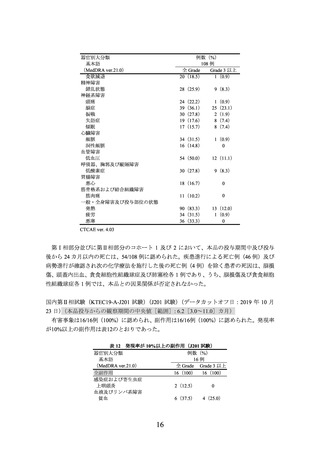
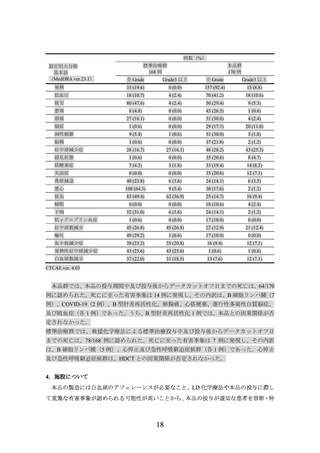
標準治療群の用法及び用量又は使用方法は、治験責任医師の判断により救援化学療法(RICE4)、R-ESHAP5)、R-GDP6)、R-DHAP7)又は R-DHAX8))のいずれかを 2~3 サイクル投
与(1 サイクル 2~3 週間)し、救援化学療法 2 又は 3 サイクル後に奏効が認められた被験
者には HSCT 併用 HDCT を実施9)することとされた。救援化学療法に奏効しなかった被験
者は、治験実施計画書外で本品を含む既承認の CAR T 細胞療法等の後治療を受けることが
可能とされた10)。
(1) 前処置の化学療法(LD 化学療法)
本品投与前の前処置としてリンパ球数が 100/μL 以上であることを確認して以下の化学療
法剤が用いられた。また、リンパ球数が 100/μL 未満の場合は、臨床試験のメディカルモニ
ターに実施可否を確認の上、LD 化学療法を実施することとされた。なお、LD 化学療法完
了から本品投与までの間隔は 2 日間とされ、本品の投与が延期された場合は延期が 2 週間
以内であれば化学療法の再実施は不要とされた。
シクロホスファミド(無水物として)(500 mg/m2 を 1 日 1 回、計 3 日点滴静注)、及
びフルダラビンリン酸エステル(30 mg/m2 を 1 日 1 回、計 3 日点滴静注)
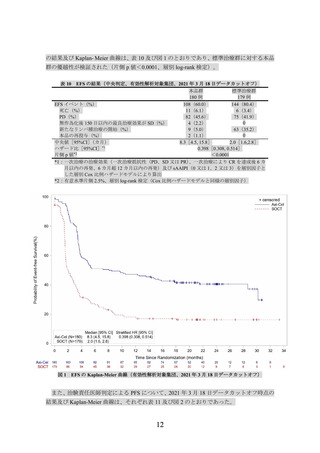
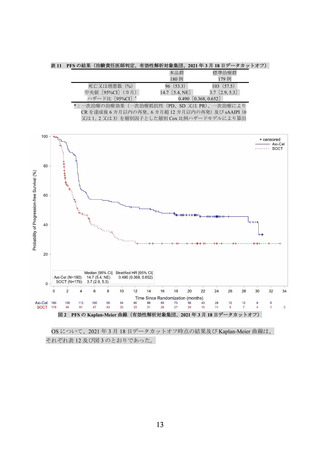
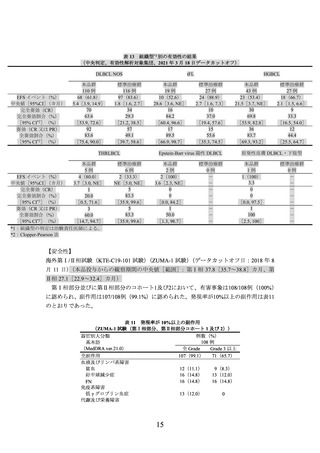
(2) ZUMA-7 試験の臨床成績
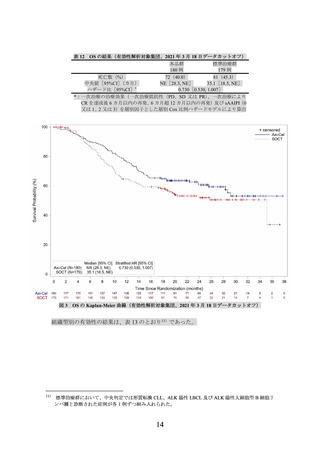
主要評価項目とされた Lugano 分類(J Clin Oncol 2014; 32: 3059-68)に基づく中央判定に
よる無イベント生存期間(無作為化日から病勢進行、新たなリンパ腫治療の開始又は死因を
問わない死亡のいずれかが最初に確認された日までの期間、以下、
「EFS」という)の主解析
4)
5)
6)
7)
8)
9)
10)
リツキシマブ 375 mg/m2 を化学療法前に、イホスファミド(メスナ併用下)5,000 mg/m2 24 時間持続投
与を第 2 日目に、カルボプラチン AUC5(最大用量 800 mg)を第 2 日目に、エトポシド 100 mg/m2 を第
1~3 日目にそれぞれ静脈内投与。
リツキシマブ 375 mg/m2 を第 1 日目に、エトポシド 40 mg/m2 を第 1~4 日目に、メチルプレドニゾロン
500 mg を第 1~4 日目又は第 1~5 日目に、シスプラチン 25 mg/m2 を第 1~4 日目に、シタラビン 2,000
mg/m2 を第 5 日目にそれぞれ静脈内投与。
リツキシマブ 375 mg/m2 を第 1 日目(又は第 8 日目)に、ゲムシタビン 1,000 mg/m2 を第 1 日目及び第
2
8 日目に、
デキサメタゾン 40 mg を第 1~4 日目に、
シスプラチン 75 mg/m(又はカルボプラチン
AUC5)
を第 1 日目にそれぞれ静脈内投与。
リツキシマブ 375 mg/m2 を化学療法前に、デキサメタゾン 40 mg を第 1~4 日目に、シスプラチン 100
mg/m2 を第 1 日目に、シタラビン 2,000 mg/m2 1 日 2 回を第 2 日目にそれぞれ静脈内投与。
リツキシマブ 375 mg/m2 を化学療法前に、デキサメタゾン 40 mg を第 1~4 日目に、シスプラチン(又
はオキサリプラチン)100 mg/m2 24 時間持続投与を第 1 日目に、シタラビン 2,000 mg/m2 1 日 2 回を第
2 日目にそれぞれ静脈内投与。
地域及び実施医療機関の基準に従って実施することとされた。
標準治療群 179 例のうち、100 例(55.8%)が標準治療後の新たなリンパ腫治療として本品を含む既承
認の CAR T 細胞療法を受けた。
11
また、生体内での本品の生着及び増殖を促進することを目的として、本品投与の 5 日前か
ら 3 日間連続で前処置として以下の LD 化学療法を行うこととされた。なお、本品製造期間
中(試験への登録から LD 化学療法前まで)に、患者の状態に応じ副腎皮質ステロイド投与
が許容され、本品投与 5 日前までに完了することとされた。
標準治療群の用法及び用量又は使用方法は、治験責任医師の判断により救援化学療法(RICE4)、R-ESHAP5)、R-GDP6)、R-DHAP7)又は R-DHAX8))のいずれかを 2~3 サイクル投
与(1 サイクル 2~3 週間)し、救援化学療法 2 又は 3 サイクル後に奏効が認められた被験
者には HSCT 併用 HDCT を実施9)することとされた。救援化学療法に奏効しなかった被験
者は、治験実施計画書外で本品を含む既承認の CAR T 細胞療法等の後治療を受けることが
可能とされた10)。
(1) 前処置の化学療法(LD 化学療法)
本品投与前の前処置としてリンパ球数が 100/μL 以上であることを確認して以下の化学療
法剤が用いられた。また、リンパ球数が 100/μL 未満の場合は、臨床試験のメディカルモニ
ターに実施可否を確認の上、LD 化学療法を実施することとされた。なお、LD 化学療法完
了から本品投与までの間隔は 2 日間とされ、本品の投与が延期された場合は延期が 2 週間
以内であれば化学療法の再実施は不要とされた。
シクロホスファミド(無水物として)(500 mg/m2 を 1 日 1 回、計 3 日点滴静注)、及
びフルダラビンリン酸エステル(30 mg/m2 を 1 日 1 回、計 3 日点滴静注)
(2) ZUMA-7 試験の臨床成績
主要評価項目とされた Lugano 分類(J Clin Oncol 2014; 32: 3059-68)に基づく中央判定に
よる無イベント生存期間(無作為化日から病勢進行、新たなリンパ腫治療の開始又は死因を
問わない死亡のいずれかが最初に確認された日までの期間、以下、
「EFS」という)の主解析
4)
5)
6)
7)
8)
9)
10)
リツキシマブ 375 mg/m2 を化学療法前に、イホスファミド(メスナ併用下)5,000 mg/m2 24 時間持続投
与を第 2 日目に、カルボプラチン AUC5(最大用量 800 mg)を第 2 日目に、エトポシド 100 mg/m2 を第
1~3 日目にそれぞれ静脈内投与。
リツキシマブ 375 mg/m2 を第 1 日目に、エトポシド 40 mg/m2 を第 1~4 日目に、メチルプレドニゾロン
500 mg を第 1~4 日目又は第 1~5 日目に、シスプラチン 25 mg/m2 を第 1~4 日目に、シタラビン 2,000
mg/m2 を第 5 日目にそれぞれ静脈内投与。
リツキシマブ 375 mg/m2 を第 1 日目(又は第 8 日目)に、ゲムシタビン 1,000 mg/m2 を第 1 日目及び第
2
8 日目に、
デキサメタゾン 40 mg を第 1~4 日目に、
シスプラチン 75 mg/m(又はカルボプラチン
AUC5)
を第 1 日目にそれぞれ静脈内投与。
リツキシマブ 375 mg/m2 を化学療法前に、デキサメタゾン 40 mg を第 1~4 日目に、シスプラチン 100
mg/m2 を第 1 日目に、シタラビン 2,000 mg/m2 1 日 2 回を第 2 日目にそれぞれ静脈内投与。
リツキシマブ 375 mg/m2 を化学療法前に、デキサメタゾン 40 mg を第 1~4 日目に、シスプラチン(又
はオキサリプラチン)100 mg/m2 24 時間持続投与を第 1 日目に、シタラビン 2,000 mg/m2 1 日 2 回を第
2 日目にそれぞれ静脈内投与。
地域及び実施医療機関の基準に従って実施することとされた。
標準治療群 179 例のうち、100 例(55.8%)が標準治療後の新たなリンパ腫治療として本品を含む既承
認の CAR T 細胞療法を受けた。
11