よむ、つかう、まなぶ。
総-5-4○最適使用推進ガイドラインについて (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00173.html |
| 出典情報 | 中央社会保険医療協議会 総会(第536回 1/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
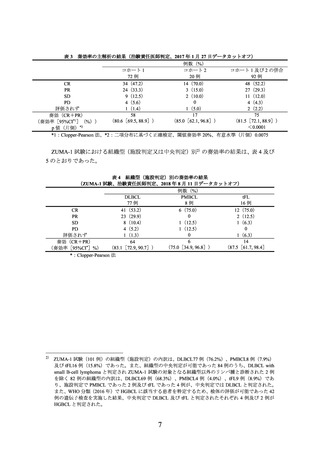
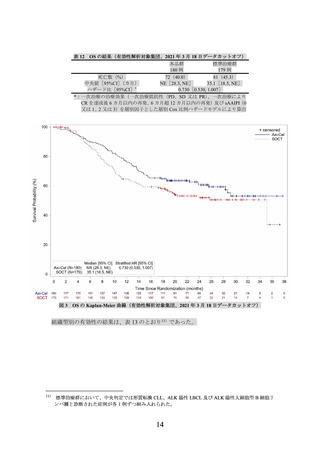
表 8 奏効率の追加解析の結果(治験責任医師判定、2019 年 10 月 23 日データカットオフ)
例数(%)
15 例
4(26.7)
CR
9(60.0)
PR
SD
1(6.7)
PD
1(6.7)
奏効(CR+PR)
13
(86.7[59.5, 98.3])
(奏効率[95%CI*](%))
*:Clopper-Pearson 法
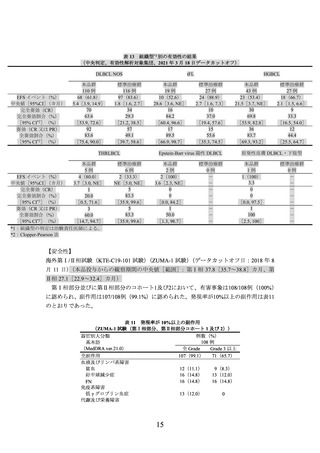
J201 試験における各組織型別の有効性の結果は、以下のとおりであった。
DLBCL14 例については、施設判定及び中央判定のいずれも 12/14 例で奏効が認めら
れ、奏効率[95%CI](%)は 85.7[57.2, 98.2]であった。
PMBCL(施設判定)1 例の効果判定は PR であった。
HGBCL(中央判定)1 例の効果判定は CR であった。
tFL(施設判定)1 例の効果判定は PD であった。
海外第Ⅲ相試験(KTE-C19-107 試験)
(ZUMA-7 試験)
18 歳以上の治療抵抗性又は再発の大細胞型 B 細胞リンパ腫患者を対象に、本品と標準治
療の有効性及び安全性を比較することを目的とした非盲検無作為化比較試験(KTE-C19-107
試験)
(以下、
「ZUMA-7 試験」という)が実施された。主な選択除外基準は表 9 のとおりで
あった。
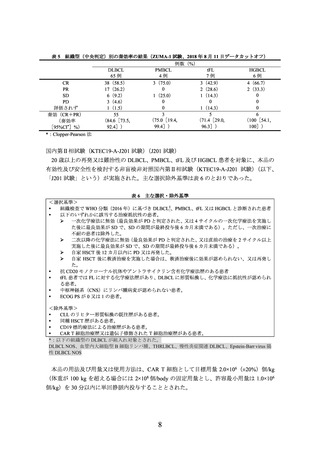
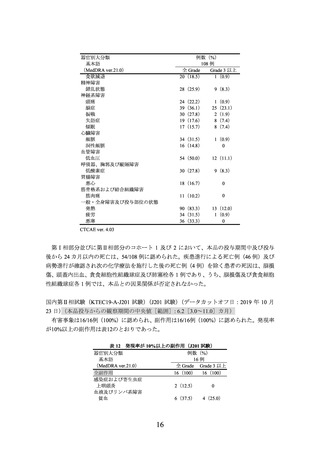
表 9 主な選択・除外基準
<選択基準>
WHO 分類(2016 年)
(Blood 2016; 127: 2375-90)に基づき、組織学的検査により以下のいずれかの
組織型の LBCL と診断された患者。
DLBCL*
tFL
HGBCL(MYC 並びに BCL2 又は BCL6 の両方か一方の遺伝子再構成の有無を問わない)
抗 CD20 モノクローナル抗体及びアントラサイクリン系薬剤を含む 1 レジメンの化学療法歴があ
り、難治性(PD、SD、若しくは PR 達成後、治療後 12 カ月以内の PD 又は生検による残存病変の
証明)又は再発した(一次治療により CR 達成後 12 カ月以内の再発)患者。
ECOG PS が 0 又は 1 の患者。
リンパ腫の中枢神経系浸潤の既往歴又は疑いのない患者。
救援化学療法に奏効した場合、自家 HSCT 併用大量化学療法(以下、
「HDCT」という)を施行する
意思のある患者。
<除外基準>
自家 HSCT 歴又は同種 HSCT 歴がある患者。
CD19 標的療法、CAR T 細胞治療又は他の遺伝子修飾された T 細胞療法の治療歴がある患者。
CLL のリヒター形質転換又は PMBCL の既往歴がある患者。
*:以下の組織型の DLBCL が組入れ対象とされた。
DLBCL NOS、慢性炎症関連 DLBCL、原発性皮膚 DLBCL・下肢型、Epstein-Barr virus 陽性 DLBCL、
THRLBCL
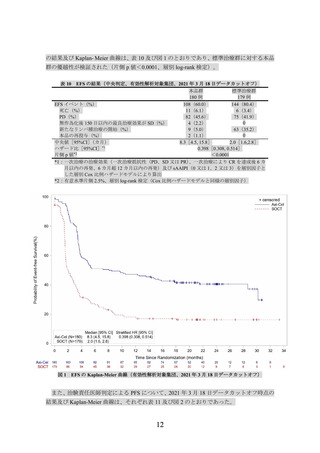
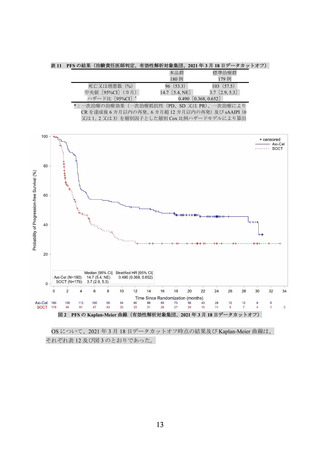
本品の用法及び用量又は使用方法は、CAR T 細胞として目標用量 2.0×106(±20%)個/kg
(体重が 100 kg を超える場合には 2×108 個/body の固定用量とし、許容最小用量は 1.0×106
10
例数(%)
15 例
4(26.7)
CR
9(60.0)
PR
SD
1(6.7)
PD
1(6.7)
奏効(CR+PR)
13
(86.7[59.5, 98.3])
(奏効率[95%CI*](%))
*:Clopper-Pearson 法
J201 試験における各組織型別の有効性の結果は、以下のとおりであった。
DLBCL14 例については、施設判定及び中央判定のいずれも 12/14 例で奏効が認めら
れ、奏効率[95%CI](%)は 85.7[57.2, 98.2]であった。
PMBCL(施設判定)1 例の効果判定は PR であった。
HGBCL(中央判定)1 例の効果判定は CR であった。
tFL(施設判定)1 例の効果判定は PD であった。
海外第Ⅲ相試験(KTE-C19-107 試験)
(ZUMA-7 試験)
18 歳以上の治療抵抗性又は再発の大細胞型 B 細胞リンパ腫患者を対象に、本品と標準治
療の有効性及び安全性を比較することを目的とした非盲検無作為化比較試験(KTE-C19-107
試験)
(以下、
「ZUMA-7 試験」という)が実施された。主な選択除外基準は表 9 のとおりで
あった。
表 9 主な選択・除外基準
<選択基準>
WHO 分類(2016 年)
(Blood 2016; 127: 2375-90)に基づき、組織学的検査により以下のいずれかの
組織型の LBCL と診断された患者。
DLBCL*
tFL
HGBCL(MYC 並びに BCL2 又は BCL6 の両方か一方の遺伝子再構成の有無を問わない)
抗 CD20 モノクローナル抗体及びアントラサイクリン系薬剤を含む 1 レジメンの化学療法歴があ
り、難治性(PD、SD、若しくは PR 達成後、治療後 12 カ月以内の PD 又は生検による残存病変の
証明)又は再発した(一次治療により CR 達成後 12 カ月以内の再発)患者。
ECOG PS が 0 又は 1 の患者。
リンパ腫の中枢神経系浸潤の既往歴又は疑いのない患者。
救援化学療法に奏効した場合、自家 HSCT 併用大量化学療法(以下、
「HDCT」という)を施行する
意思のある患者。
<除外基準>
自家 HSCT 歴又は同種 HSCT 歴がある患者。
CD19 標的療法、CAR T 細胞治療又は他の遺伝子修飾された T 細胞療法の治療歴がある患者。
CLL のリヒター形質転換又は PMBCL の既往歴がある患者。
*:以下の組織型の DLBCL が組入れ対象とされた。
DLBCL NOS、慢性炎症関連 DLBCL、原発性皮膚 DLBCL・下肢型、Epstein-Barr virus 陽性 DLBCL、
THRLBCL
本品の用法及び用量又は使用方法は、CAR T 細胞として目標用量 2.0×106(±20%)個/kg
(体重が 100 kg を超える場合には 2×108 個/body の固定用量とし、許容最小用量は 1.0×106
10